zurück zu Kapitel III
- 1. Einteilungen der Capillaren
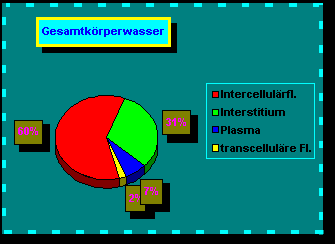
- Wasserverteilung im Körper (Graphik)
- 2. Diffusion
- 3. Filtration und Reabsorption
- 4. Mögliche Ursachen einer veränderten effektiven Filtration
- 5. Skizzen zur Filtration und Reabsorption unter verschiedenen Bedingungen
- 6. Zwischenfragen
1. Einteilungen der Capillaren
Der Ort des Geschehens ist eimal mehr eine Membran, bzw. die Capillarwand. Man unterscheidet zumindest in:
- Capillaren mit durchgehender Membran (z.B. im Skeletmuskel, blatter Muskulatur, BG, Fett, Lunge);
- Capillaren mit gefensterter Membran (z.B. Niere, Darm);
- Capillaren mit diskontinuierlicher Membran (z.B. Knochenmark, Sinus der Leber und Milz) bezgl. genauerer Einteilung siehe Lehrbücher der Histologie.
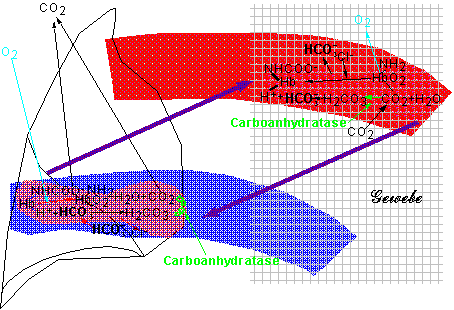
Als mittlerer Durchmesser kann 6 µm angenommen werden (die verformbaren Ery. müssen noch passieren können). Wird weiters eine Länge von ca. 750 µm angenommen, wobei die Venolenmembran – die auch noch am Austauschvorgang beteiligt ist – einbezogen ist, so ergibt sich eine Austauschfläche von ca. 0,02 mm² pro Capillare und wenn 4 * 1010 Capillaren insgesamt vorhanden sind, beträgt die Gesamtaustauschfläche ca. 1 000 m².
42) Transportvorgänge zwischen Blut und Gewebe weiterlesen