zurück zu Kapitel III

- Einteilung der Abwehr
- 1. Unspezifisches Immunsystem
- 1.1 Allgemeine unspezifische Abwehr
- 1.2 Die unspezifischen humoralen Systeme
- 1.2.1 Das Komplementsystem
- 1.2.1.1 Klassisches Komplementsystem
- 1.2.1.2 Alternatives Komplementsystem
- 1.2.2 Kinin-Kallikrein-System
- 1.2.3 Lipidmediatoren
- 1.2.4 Interleucine und Interfeone
- 1.2.5 Sauerstoffradikale
- 1.2.6 Biogene Amine
- 1.3 Die unspezifische zelluläre Abwehr
- 1.3.1 Neutrophile Granulocyten
- 1.3.2 Eosinophile Granulocyten
- 1.3.3 Basophile Granulocyten
- 1.3.4 Mastzellen
- 1.3.5 Monocyten/Makrophagen (Mo/Ma;MPS)
- 1.3.6 Zytotoxische Zellen
- 2. Das spezifische Abwehrsystem (Immunsystem)
- 2.1 Das HLA-System
- 2.2 Zelluläre spezifische Abwehr (zelluläre Immunität)
- 2.3 Humorale spezifische Abwehr
- 2.3.1 Antikörper
- 2.3.2 Diversität der AK
- 2.3.3 Verstärkte Antwort; Überempfindlichkeitsreaktionen
- 2.3.4 Immunsupression
- 3. Zwischenfragen
Einteilung der Abwehr (man kann die Abwehr z.B. folgendermaßen einteilen)
- 1. Unspezifisches Immunsystem
- 1.1 Allgemeine unspezifische Abwehr
- 1.2 Die unspezifischen humoralen Systeme (der humorale Schenkel der natürlichen Abwehr)
- 1.2.1 Das Komplementsystem
- 1.2.2 Kinin-Kallikrein-System, Gerinnungs- und fibrinolytisches System
- 1.2.3 Lipidmediatoren
- 1.2.4 Interleukine und Interferone
- 1.2.5 Sauerstoffradikale
- 1.2.6 Biogene Amine
- 1.3 Die unspezifische zelluläre Abwehr (der zelluläre Schenkel der natürlichen Abwehr)
- 2 Spezifisches Abwehrsystem (Immunsystem)
- 2.1 Zelluläre spezifische Abwehr (zelluläre Immunität)
- 2.2 Humorale spezifische Abwehr (humorale Immunität)
1. Unspezifisches Immunsystem
1.1 Allgemeine unspezifische Abwehr
Physikalische und biochemische Barrieren kann man ganz allgemein dem unspezifischen System zuordnen, welches sich vom spezifischen v.a. darin unterscheidet, daß es immer in gleicher Form und Stärke wirkt, d.h., daß man nicht in primäre und sekundäre Antwort unterscheiden kann, und eben keine verbesserte Antwort bei wiederholtem Kontakt erfolgt, wie beim spezifischen System.
Zu den unspezifischen Barrieren sind zu rechnen:
- Die unbeschädigte Haut (incls. Drüsen und Anhangsgebilden; Fettsäuren);
- Reinigung durch Cilienbewegung und Spülung (Trachea, Harnwege);
- Schleim (Einseifen von Mikroorganismen);
- pH-Sprünge (Magen – duodenum);
- Besetzung ökologischer Nischen durch Symbionten und Kommensale und
- das in der ECF vorkommende Lysozym (von nGc stammend; N-Acetylglucos- amin und N-Acetylmuraminsäure der Bakterienwand spaltend).
1.2 Die unspezifischen humoralen Systeme
(der humorale Schenkel der natürlichen Abwehr):
1.2.1 Das Komplementsystem
Die Faktoren des Komplementsystems werden mit C (von complement) bezeichnet und nummeriert. Es gibt die Faktoren C1q, C1r, C1s, C2 bis C9, C3b, B, D, P (von Properdin) H und I (Ca++; Mg++). Sie haben die Fähigkeit, körperfremde Zellen zu zerstören und körpereigene Zellen zu aktivieren. Weiters können sie AG-AK-Komplexe aufzulösen und AK vervollständigen (komplementieren).
Die Komplementfaktoren liegen, wie die Inhibitoren C1-INA, C4bp, C6bp, DAF und MCP im Plasma als inaktive Proenzyme (Zymogene) vor und können einerseits über den klassischen und andererseits über den alternativen Weg aktiviert werden.
Außerdem durch Serinesterasen (Gerinnungs- und fibrinolytisches System) und durch Proteinasen, welche C3 spalten können.
1.2.1.1 Klassisches Komplementsystem
AG-AK-Komplexe, die durch IgG oder IgM gebildet wurden, stimulieren meist den klassischen Weg, indem sie C1q binden.
Auch Heparin, C-reaktives Protein, einige Viren und Bakterien können das klassische System starten.
Durch die C1q-Anlagerung kommt es zu einer Konformationsänderung, wodurch nun auch C1r und C1s gebunden werden kann. C1s spaltet daraufhin C4 in C4aq und C4b und C2 kann sich anlagern.

Mit der C3-Spaltung ist der Knotenpunkt des klassischen und alternativen Systemes erreicht.
Der Komplex C4,2 wird als C3-Konvertase des klassischen Systems bezeichnt.
1.2.1.2 Alternatives Komplementsystem
Gebundenes C3b lagert den Faktor B an. an diesem Komplex kann nun vom Faktor D der angelagerte Faktor B gespalten werden, sodaß C3b-Bb und Ba entsteht. C3b-Bb wird als C3-Konvertase des alternativen Systems bezeichnet. Beide C3 Konvertasen vermögen sowohl C3 als auch C5 zu spalten.
Faktor P verhindert eine zu schnelle Inaktivierung des C3b-Bb-Komplexes.
Da durch beide C3-Konvertasen C3b entsteht, ergibt sich eine autokatalytische Schleife mit lawinenartigen Charakter.
Alternativ wird wird diese Schleife durch Aktivoberflächen aktiviert:
AG-AK-Komplex, Endotoxine, (Zell-)membranen von Viren, Bakterien, Protozoen, virusinfizierte oder maligne transformierte Zellen wirken als solche.
Normalerweise wird die C3b-Aktivierung durch den Faktor H behindert.
Die C3 Konvertasen können, wie gesagt, den Faktor C3 in C3a und C3b, und den Faktor C5 in den Faktor C5a und C5b spalten. Durch die C5-Spaltung wird Die Bildung des MAC (membranattack complex´)m eingeleitet. Ab der C5-Spaltung zeigt sich eine gemeinsame Endstrecke des alternativen und klassischen Weges.
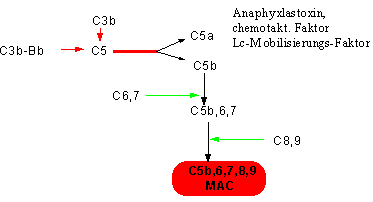
C5a ist eine wichtige chemotaktisch wirkende Substanz und auch ein Anaphylatoxin.
Faktor C5b kann schließlich die Faktoren C6,7,8 und 9 zum MAC binden.
Dwe dadurch entstehende, lytische MAC wirkt nun ungefähr so, daß C5b den Komplex an der Membran verankert. C6 und C7 treiben den C8 wie einen Bohrstift in die Zelle. Am C8 entlang können dann die ringförmigen C9-Polymerisationsprodukte in die Zelle gleiten, wodurch eine ausgekleidete Röhre entsteht. Es kommt zum Ausgleich der Ionengradienten und zum Austritt von ICF, und somit zur Lyse der Zelle.
Der MAC bewirkt also die Lyse der Zelle.
Neben der lytischen Wirkung hat da Komplementsystem u.a. noch die wichtige Aufgabe der Opsonisierung und der Freisetzung biologisch wirksamer Fragmente, wie den Faktor 5a (Chemotaxis, Einfluß auf den Arachidonsäurestoffwechsel, Mastzellenaktivierung…).Verschiedene Phagocyten besitzen Receptoren für Komplementfaktoren (CR) einerseits, und andererseits für AK (Fc-Receptoren), wodurch sie opsonisierte Partikel (Partikel, die eine Substanz [Opsonin] gebunden haben), welche die Phagocytose erleichtert bzw. überhaupt erst ermöglicht, z.B. IgG oder IgM + C3b, u.a.), phagocytieren können.
Beim proteolytischen Abbau von C3b entsteht übrigens C3e, welches als Entzündungsmediator und bei der Mobilisierung von Leucocyten aus dem Knochenmark eine Rolle spielt.
C3b-Receptoren (=CR1) findet man z.B. an Monocyten und Makrophagen sowie an B- und T-Lymphocyten.
C3b und AK können nach Bindung an CR1 bzw. FcR eine Phagocytzose auslösen; C3b alleine allerdings nicht.
CR2-Receptoren für C3d und iC3b (iC3b ist eine weitere wichtige C3-Konvertase des alternativen Systems, auf die ich hier aber nicht näher eingehen möchte) findet man nur auf B-Lymphocyten (Beteiligung an der Regulation der B-Zell-Stimulation und Proliferation).
CR3 -Receptoren binden an iC3b und an Mikroorganismen. Man findet sie an Monocyten und Makrophagen, an Gc und an großen, granulierten Lyc.
CR3 ist „der“ Receptor für die Phagocytose.
Über Faktor-H-Receptoren der Makrophagen kommt es bei Bindung zur Stimulation des Arachidonsäurestoffwechsels.
Über C3e zur Lyc-Ausschwemmung aus dem Knochenmark – Produktionsleucocytose.
Receptoren für C3a und C5a (Anaphylatoxine) findet man an Mastzellen, Gc,Makrophagen und ev. Lyc, sowie an glatten Muskelzellen.
Chemotaxis, Anhaftung, der Gc und Mc an die Gefäßwände, IL-1-Freisetzung aus Makrophagen wird bewirkt.
Chemotaktisch wirksam sind außer C5a und Interleukin 1 (IL-1) noch PAF aus den Thc, Fibrinogen-Spaltprodukte, Bakterienprodukte u.a.
Bei anderen Stoffen hingegen, z.B. Kieselsäure, kann man eine Flucht der Lc bemerken.
1.2.2 Kinin-Kallikrein-System
Gerinnungs- und fibrinolytisches System:
Der HMW-Kininogen-Präkallikrein-Kompex (Fitzgerald, Fletcher), wird durch negative Oberflächen (Glas, Kaolin, Silikon, Basalmembran der Gefäße, Knorpelgrundsubstanz, Lipopolysaccharide, Glykolipide…) aktiviert, wodufrch sich der Gf XI anklagern kann.
Auch der Hagemannfaktor (HF) wird durch negativ geladene Oberflächen aktiviert, sowie durch bereits aktiven HF (HFa).
HFa kann nun HF, Präkallikrein und FXI( wie F VII, aber auch Plasminogen und den Komplementfaktor C1 (Verbindungsstelle genanner Systeme) aktivieren.
Über F XII, XI und HFa wird also nicht nur die sekundäre Hämostase und gleichzeitig auch die Fibrinolyse über die Plasminogenaktivierung (Fibrinogen-Spaltprodukte wirken chemotaktisch) gestartet.
Weiters aktiviert auch Thrombin einen Kompementfaktor, nämlich C3, also nicht nur Fibrinogen (weitere Verbindungsstelle).
Plasmin spaltet (wieder eine Verbindungsstelle) C1, C3, C5, HF, und Fibrin.
Kallikrein spaltet Kininogene, wobwei Kinine entstehen. Ein Spaltprodukt (über Kinase I und II) ist Bradykinin, welches u.a. folgendes bewirkt:
Senkung des BD (tpWê) bei Zunahme der Hf und des SV (also des HMV), Kontaktion der Bronchialmuskulatur, Aktivierung der Phospholipase A2.
1.2.3 Lipidmediatoren
Siehe Frage „Gewebehormone“. Hier sei nur erwähnt, daß die Prostaglandine der E-Reihe (insbes. PGE2) bei akuten Entzündungen wirksam werden (Vasodilatation, Permeabilitätserhöhung der Gefäße…). Weiters sei an dieser LTB4 unter den Leukotrienen hervorgehoben, welches u.a. chemotaktisch wirksam ist (Freisetzung aus nGc); es führt auch zur verstärkten Freisetzung von lysosomalen Enzymen und zur Sauerstoff-Radikal-Bindung.
Die T-Helferzellen werden durch LTB4 zu ungunsten von T-Supressor-Zellen gefördert.
Einige Metabolite des Arachidonsäurestoffwechsels fördern die Proliferation von Fibroblasten.
Der platelet activating factor (PAF) aus Mastzellen, Gc, Mc, Thc, Endothelzellen und Makrophagen steigert die Gefäßpermeabilität und führt weiters zur Constriction der Bronchialmuskulatur, sowie zur Aggregation von Thc. Auch die Freisetzung von Serotonin, ADP u.a. aus Thc ist eine Folge der PAF-Wirkung.
1.2.4 Interleucine und Interfeone
Interleukin 1 (IL1) wird von Makrophagen u.a. Zellen freigesetzt. Es stimuliert die Hämatopoiese und aktiviert T-Helferzellen, Gc, Fibroblasten, Endothelzellen u.a. Als endogenes Pyrogen bewirkt es (PG-Bildung – Hypothalamus) eine Erhöhung der Körperkerntemperatur, sowie eine Produktion von „Akute-Phase-Proteinen“. Weiters kann es Lyc mobilisieren.
IL-2 wird von T-Helferzellen produziert, wirkt aber auf alle T-Lyc als Wachstums- und Differenzierungsfaktor.
IL-3 wirkt sich auf die Hämatopoiese (multi-colony.-stimulating-factor = MCSF) sowie auf die Matzellen-Reifung und NK-Zellen-Aktivierung aus.
Als B-cell-stimulating-factor (BSF) wirken IL-2, IL-4, IL-5, IL-6 und IL-7. IL-5 stimuliert auch die Differenzierung der eGc.
Die Interfeone (IFN) lassen sich in vier Klassen einteilen.
Der Klasse I gehören IFN- (aus durch Viren oder RNS stimulierten B-Lyc), und IFN- (aus durch Viren, Bakterien, RNS u.a. stimulierten Fibroblasten) an. IFN sind Proteine mit antiviraler Wirksamkeit.
Das -IFN der Klasse II wird nur von stimulierten T-Zellen freigesetzt. Es hemmt das Wachstum von Viren, und kann die Expression von MCH-Determinanten (MCH = major histocompatibility complex) der Klasse II ändern.
IFN der Klasse IV werden auch als TNF tumor necrosis factor bezeichnet.
Wird eine Zelle durch ein Virus infiziert, so kann sie IFN sezernieren, welche an benachbarten Zellen binden können. Durch diese Bindung kommt es zu einer Reihe an Veränderungen in der betroffenen Zelle (Aktivierung best. Gene, Verminderung von DNS- und RNS-Synthese, Änderung an der Zellmembran). Außerdem wird durch IFN die Aktivität von NK-Zellen und Makrophagen gesteigert u.a.m.. wodurch sich der sog. Antitumoreffekt ergibt.
1grch. pyon = Eiter; pyogen also eine Eiterung erregend; lat. pus = Ebenfalls Eiter
1.2.5 Sauerstoffradikale
Über eine membranständige NADPH-Oxidase von Lc (Makrophagen) kann das Superoxid-Radikal-Anion = .O2- freigesetzt werden (zweifache Elektronenübertragung auf ein =2). Aus O2 ensteht gleichzeitig ein Radikal und ein Anion.
Die Produktion durch Phagocyten ist nach deren Stimulation wesentlich erhöht. Aus Wasserstoffperoxid (H2O2) können dann Hydroxyl-Radikale oder unterchlorige Säure entstehen. Angeregter O2 – sog. Singulett-Sauerstoff – kann aus HOCL mit H2O2 entstehen, aus .O2– und aus dem Arachnoidstoffwechsel.
Weiters sind noch das Superoxidradikal (.OOH) und das Hydroxy-Radikal (.OH) zu erwähnen
Inaktiviert werden die für alle Organismen sehr gefährlichen reaktiven Sauerstoffmetabolite, die v.a. bei Entzündungen auftreten, durch Superoxid-Dismutase, Katalasen, und die Gluthation-Peroxidase.Leucocyten und speziell Makrophagen setzen die toxischen O2- Metaboliten neben lytischen Enzymen ein um z.B. Bakterien abzutöten und zu phagozytieren.
Im entzündeten Gebiet kommt es durch Konzentrierung aktiver Lc zu einer Konzentrationserhöhung von reaktiven O2-Metaboliten. Weiters setzen die Lc Elastase (kollagenabbauende Protease) frei, die normalerweise durch a1-Antitrypsin gehemmt wird. Im entzündeten Gebiet wird aber a1-Antitrypsin durch die O2-Metabolite gehemmt, wodurch sich die Elastase in ihrer Aktivität entfalten kann.
1.2.6 Biogene Amine
Siehe Frage „Gewebehormone – Histamin, Serotonin“.
1.3 Die unspezifische zelluläre Abwehr
Für die unspezifische zelluläre Abwehr, die ebenfalls nicht zum Immunsystem gehört – Immunität kann nur durch das spezifische Abwehrsystem = Immunsystem erreicht werden – sind vor allem Lc verantwortlich, die durch ausgesprochen hohe Phagocytosefähigkeit auffallen.
Mikrocyten (nGc) und Makrocyten, bei denen diese Fähigkeit besonders ausgeprägt ist, nehmen daher die wichtigste Stellung bei der unspezifischen zellulären Abwehr ein.
Aber nicht nur Phagocytose, sondern auch „umgekehrt Phagocytose“, bzw. Freisetzung von Granula-Inhalten, spielen bei diesem System eine welentliche Rolle. Die Grenzen zum spezifischen System müssen natürlich willkürlich gezogen werden, da die gesamte Abwehr Hand in Hand arbeitet. Zellen des unspezifischen Systems leisten einerseits Vorarbeit für das spezifische System (AG-Präsentation durch Makrophagen) und andererseits wird z.B. den nGc die Zielzellenerkennung durch Opsonine (z.B. IgG. die vom spez. System stammen) erleichtert.
Ich möchte hier ganz kurz wesentliche Aufgaben von Makrophagen (Mc), Gc, Mastzellen und zytotoxischen Lyc erwähnen.
Zuerst aber ein paar Worte zu der grundlegenden Fähigkeit der Mikro- und Makrocyten, der Phagocytose:
Zuerst wird der Phagocyt durch verschiedene, chemotaktisch wirksame Substanzen angelockt. Diese können z.B. von Bakterien stammen. Die eGc werden auch durch Substanzen zur Migration bewegt, die ein bGc freigesetzt hat.
Häufig wirken Faktoren des Komplementsystems (C5a) als „Lockstoff“. BGc und Mastzellen können nGc durch den sog. NCF (neutrophil chemotactic factor) anlocken. Durch die chemotaktisch wirksamen Substanzen wird z.B. über Membranreceptoren im nGc eine Esterase aktiviert, die über Actin-..Myosin-Wechselwirkungen im Endeffekt eine amöboide Bewegung ermöglicht.
Sind die zu phagocytierenden Partikel opsonisiert, so kann der Phagocyt an die CR1, CR2 und Fc-Receptoren anhaften. Aber auch an nicht-opsonisierten Partikeln können Phagocyten über bestimmte, aber „unspezifische“ lecithinartige bzw. kohlenhydrathaltige Proteine Receptoren binden.
Nach diesem attachment zwischen Phagocyt und Partikel kommt es zur Umfließung (ingestion oder Invagination) der zu phagocytierenen Partikel. Dabei stülpt sich die Zellmembran über die Partikel und ein Phagosm wird gebildet. Durch die Verschmelzung der Phagosomen mit Lysosomen entstehen Phagolysosomen, in denen die Granulainhalte der Lysosomen ihre Wirkung entfalten können. Es erfolgen ph-Änderungen im Phagolysosom, kationische Proteine, Lysozym und toxische O2-Metabolite werden wirksam und führen z.B. zur Zerstörung von Bakterien. Ein Teil der Abbauprodukte und ev. auch der Receptor, an dem das Partikel anhaftete, wird recycled. Der unbrauchbare bzw. unverdauliche Teil wird durch Exocytose wieder an dem Inter- bzw. Extracellulärraum abgegeben.
1.3.1 Neutrophile Granulocyten
Die erste Abwehrfront der unspez. Abwehr wird durch die nGc gebildet. Sie haben die höchste Wirksamkeit gegen pyogene*1 Bakterien, also Staphylo-, Strepto-, Gono- und Meningokokken, gegen Enterobactericeae u.a.

Die nGc zerfallen dabei zu sog. Eiterkörperchen. Um die Inhaltsstoffe der Granula (kationische Proteine, saure Hydrolasen wie saure Phosphatase, Esterasen, Lysozym, Kolla-gense, Lactoferrin, Neutrophilen-Peroxidase u.a.) zur Wirkung kommen zu lassen, muß – abgesehen von der sog. umgekehrten Phagocytose, bei der die Granulastoffe nach außen abgegeben werden – das Partikel in die Zelle aufgenommen werden. Dazu ist eine vorrausgehende Bindung an Receptoren der nGc-Membran Vorraussetzung. An nGc-Membranen findet man daher Fc-Receptoren für AK (IgG), weiters CR1-, CR2-, CR4- und H-Receptoren, sowie Receptoren für C3a und C5a.
Die nGc verlassen nach relativ kurzem Aufenthalt im Blut (etwa 8 h) ihr Transportmittel und überleben auch im peripheren Gewebe – h.s. Lamina propria der Submucosa – nicht lange (ca. 2-3 d).
Die typische Wanderungsform sieht i.a. etwa wie in Skizze x gezeigt aus:
Die Verformbarkeit erleichtert den Gc die Diapedese (Verlassen der Gefäße zwischen Endothelzellen), und ermöglicht ihne eine gute Beweglichkeit.
1.3.2 Eosinophile Granulocyten
Auch die eGc sind gut beweglich und zur Phagocytose fähig.
Sie erfüllen eine wesentliche Aufgabe bei der Abwehr parasitierender Helminthen (Würmer), von denen sie chemotaktisch angelockt werden. Sie wirken dabei v.a. durch Zerfall und Freisetzung toxischer Substanzen ihrer Granula.
Außerdem können sie Substanzen der Mastzellen und bGc (v.a. Histamin) inaktivieren, wodurch sie diesen teilweise entgegenwirken können.
Eosinophilie findet man außer bei Helmintheninfektion daher auch bei allergischen Reaktionen (Hemmung überschießender Reaktionen), und man kann sie auch bei verschiedenen Autoimmunerkrankungen vermehrt feststellen.
Die Granula enthalten neben Histaminase, Peroxidase, Dipeptidase, Phospholipase B, Kristall-Proteine (im Internum der Granula) und Neurotoxin, ein spezifisches, wichtiges Protein, welches in hoher Konzentration vorkommt und die Anhaftung an Helminthen erleichtert. Die Hauptaufgabe dieses Proteins ist die Abtötung von Helminthenlarven, aber es kann auch Histamin aus Mastzellen freisetzen (obwohl die Granula andererseits, wie erwähnt, auch Histaminase enthalten).
Bei der Abwehr von Helminthen wirken aber auch Makrophagen, das Komplementsystem, das spezifische Abwehrsystem, Mastzellen und bGs mit.
1.3.3 Basophile Granulocyten
Die Granula der bGs enthalten Histamin (Gefäßerweiterung, Permeabilitätssteigerung, Spaltung von Chylomikronen im Blut), Heparin (Gerinnungshemmung, Spaltung von Chylomikronen), Peroxidase u.a. Substanzen.
An speziellen Fc-Receptoren können die Basophilen IgE-AK gebunden haben, wodurch sie fähig werden, mit AG Komplexe zu bilden und weshalb sie in weiterer Folge Histamin aus ihren Granula freisetzen können.
1.3.4 Mastzellen
Sie gleichen in einigen Eigenschaften den bGc. Auch ihre Granula enthalten Histamin und Heparin, aber auch saure und alkalische Phosphatasen u.a. Substanzen.
Sie können abenfalls IgE an Ihre membranständigen Fc-Receptoren binden.
Man findet die Mastzellen v.a. im Bindegewebe unter der Haut und Schleimhaut – bevorzugt in Gefäßnähe.
Ihre wichtigste Aufgabe erfüllen sie bei Entzündungsreaktionen und bei der Abwehr von AG, welche mit IgE einen Komplex bilden können.
Auch bei der Schmerzentstehung könnten sie eine Rolle spielen, da Histamin aus Nervenendigungen Substanz P (Neurokinin) freisetzen kann, und Substanz P wiederum Mastzellen aktivieren kann (positive Rückkoppelung).
1.3.5 Monocyten/Makrophagen (Mo/Ma;MPS)
Die Mo und Ma bilden das Mononucleäre-Phagocytirene-System (MPS).
Achtung! auch die oft als „plynucleär“ bezeichneten Gc sind lediglichen segmentkernig, nicht mehrkernig. Für die Makrophagen gibt es eine Reihe von Bezeichnungen, die ort- oder funktionsbezogen sind, oder aber nach dem Ent decker benannt sind:
- þ Histiocyten – im BG; als Abräumzellen ist ihre Hauptaufgabe die Phagocytose (Mikroorganismen, anorganische, organische und biologische Bestandteile – tingible bodies);
- Anmerkung für Mediziner mit naturwissenschaftlicher Inklination respektive Ambition: anorganisch ¹ organisch ¹ biologisch!
- þHofbauerzellen – in der Plazenta
- þMesangium-Makrophagen – in den Nierenglomerula
- þUferzellen – phagozytieren in der Milz überaltete Ery
- þAmmenzellen – im Konochnmark
- þOsteoklasten – vielkernige Zellen im Konochengewebe (Abbau)
- þEndothel-Makrophagen – zwischen Endothelzellen
- þKupfersche sternzellen – in den Lebersinus
- þLangerhans’sche Zellen in der Dermis
- þUfer und Brückenzellen in dem Lymphknoten und an anderen Stellen
- þAlveolar-Makrophagen
- þSerosa-Makrophagen
- þSynovial-Makrophagen
- þRiesenzellen und EpitheloidZellen (in Granulomen)
- þMikrogliazellen – phagocytierende Zellen des ZNS
- þInterdigitierende und dendritische Zellen
Letztere sind AG präsentierende Ma, die unter den Endothel-Ma, den Histiocyten der Milz, den Langerhanszellen der Haut und v.a. in den Lymphknoten zu finden sind.
Die dendritischen Ma sind dabei im Keimzentrum, wo die Proliferation der B-Lyc stattfindet, anzutreffen.
Die interdigitierenden Ma hingegen in der Randzone, wo die T-Lyc vermehrt und aktiviert werden – im Thymus sind sie an der Erkennung von „selbst“ und „fremd“ beteiligt.
An der Ma-Membran sind Fc-Receptoren für IgG und IgE, CR1, CR3, C5a und charakteristische Receptoren für Lymphokine und HLA-DR befestigt.
Die Ma können auch Bakterien und Protozoen phagozytieren.
Sie billden damit die zweite zelluläre Abwehrreihe nach den nGc.
Die wichtige Aufgabe der Lyc-Aktivierung bewältigen sie durch IL-Produktion, AG-Endocytose und -Verarbeitung mit anschließender Präsentation. Weiters erfüllen sie ihre Aufgabe durch Sezernieren von Mediatoren, die auf das Komplement- und Gerinnungssystem, auf den Arachidonsäurestoffwechsel, auf Fieber und Entzündung und v.a. auf die „Aufräumarbeit“ (hydrolytische Enzyme) einen Einfluß haben.
Sie tragen auch zu einer Erhöhung der reaktiven Sauerstoffmetaboliten bei. Bei der Zytotoxität angelangt, möchte ich noch kurz die zytotoxichen Löymphocyten erwähnen.
1.3.6 Zytotoxische Zellen
Unter den zytotoxischen Zellen, die der unspezifischen Abwehr zuzurechnen sind (es gibt auch zytotoxische Zellen, die sensibilisiert sein müssen, um wirksam werden zu können – zytotoxische T-Zellen) möcht ich nur die großen granulierten Lyc anführen. Es handelt sich um Killerzellen (K-Zellen) und natürliche Killerzellen (NK-Zellen), die viele verschiedene (unspezifisch) AG abwehren können.
K- und NK-Zellen sind, wie noch nicht ausdifferenzierte Vorläuferzellen, weder den B- noch den T-Lyc eindeutig zuzuordnen und werden daher auch als Nullzellen bezeichnet.
Besonders wichtig sind sie bei der Abwehr virusinfizierter Zellen und bei der Verhinderung der Metastasierung von Tumoren.
Es werden also nicht nur Zellen eines anderen Individuums (Organtransplantat) und Zellen einer anderen Art (Mikroorganismen) als fremd erkannt, sondern auch von Mikroorganismen befallene Zellen und Tumorzellen (natürlich nur in einem gewissen Umfang, sonst würde es ja schon bei intakter unspezifischen Abwehr kaum Tumoren und Infektionskrankheiten geben).
K-Zellen vermögen antigenabhängig aber anftigenunspezifisch Zellen zu zerstören die mit IgG beladen sind.
NK-Zellen können antigen- und antikörperunabhängig Zellen (Tumorzellen) angreifen.
Die großen granulierten Lyc vermögen mittels sog. Polyperforine (Granulainhalt) die Membran der Zielzellen zu perforieren, wodurch weitere Granulainhalte eindringen können und der Zelluntergang durch Apoptose (Zerfall in kleine Vesikel) bewirkt wird.
Es wurde bereits erwähnt, daß es auch spezifische zytotoxische Lyc. gibt, diese sollen nun zur spezifischen Abwehr überleiten.
2. Das spezifische Abwehrsystem (Immunsystem)
Da die humorale Immunreaktion selbstverständlich auch von bestimmten Zellen, nämlich dem B-Lyc-Sytem ihren Ausgang nimmt, und gerade die zelluläre unspezifische Abwehr besprochen wurde, soll hier zuerst der zelluläre Schenkel der spezifischen Abwehr angeführt werden.
2.1 Das HLA-System
Das Immunsystem hat die Aufgabe der Wahrung der Identität und Integrität eines Individuums. Bevor auf diese Aufgaben eingegangen werden kann muß die Identität eines Individuums näher erklärt werden.
Alle Zellen eines Individuums bekommen durch den MHC (major histocompatibility complex) ein gemeinsames Merkmal. Unter MHC wird der Locus eines Genoms verstanden, an dem für die charakteristischen Oberflächeneigenschaften aller Zellen eines Individuums codiert wird.
Beim Menschen wird der MHC im Unterschied zu anderen Arten als HLA (Human-Leukocyten-Antigen) bezeichnet. Dieser MHC bzw. HLA ist beim Menschen am Chromosom 6 lokalisiert und läßt sich, in Abhängigkeit von den AG-Klassen für die codiert wird, in verschiedene Loci unterteilen.
AG der Klasse I (es gibt übrigens drei AG-Klassen bei den Säugetieren) werden z.B. in den Loci A, B und C des MHC codiert. AG (Glykoproteine) deren Code in den Loci A, B oder C liegen, und die an Oberflächen von Zellen (besonders Lyc) zu finden sind, werden auch als SD (serologisch definierbare) Antigene bezeichnet, da sie mittels spezifischer AK erkannt werden.
Der Klasse II gehören AG an, die am D-Locus oder am DR-Locus codiert sind. HLA-DR AG können aber ebenfalls wie AG der I-Klasse und im Unterschied zu HLA-D AG mit spezifischen AK nachgewiesen werden.
An den Loci für Klasse III AG wird für die Komplementkomponenten C2, C4, B usw. codiert.
Die Bedeutung des HLA-Systems liegt v.a. in der Regulation der Immunantwort und in der Kommunikation der Zellen des Immunsystems.
Die Kenntnis des HLA-Systems ist nicht nur für Organtransplantationen und die Bekämpfung von Autoimmunerkrankungen wesentlich, sondern sie ist auch Vorraussetzung zum Verständnis der Prinzipien nach denen das Immunsystem funktioniert. Trotz dieser eminenten Bedeutung kann ich hier nur auf Bücher der Immunologie (Roith) verweisen, da MedicArt nur einen Überblick und nicht eine spezielle Vertiefung bieten soll.
2.2 Zelluläre spezifische Abwehr (zelluläre Immunität)
Für die zelluläre Immunreaktion sind die T-Lyc (Prägung im Thymus) verantwortlich.
In der lymphatischen Reihe ( im Knochenmark bzw. embryonal in der Leber) findet man Lyc, die durch saure Phosphatase und den Receptor CD2 („Schafsery-Receptor oder auch E-Receptor“) von den B-Lyc unterscheidbar sind. Diese T-Lyc wandern in den Thymus, wo sie bestimmte Marker exprimieren.
CD4 ist an Ti (inducing cells) und Th (helping cells),
CD8 an Ts (supressing cells) und Tc (cytotoxic cells) zu finden, wodurch eine weitere Kategorisierung der T-Lyc möglich wird.
Im Thymus lernt der T-Lyc sozusagen zwischen „Selbst“ und „Nicht-Selbst“ unterscheiden. Er lernt dabei die eigenen HLA kennen und wird durch Wechselwirkung mit der Mikroumgebung (Epithelzellen, Fasernetze…) geprägt. Dieser erste Kontakt mit der Umgebung als T-Lyc (vor der Markerexprimierung handelt es sich ja noch um Vorläuferzellen) ist also ausschlaggebend für die Fähigkeit zwischen selbst und fremd zu unterscheiden.
Zinkernagel und Doherty haben 1974 erkannt, daß Tc aufgrund der Erkennung von MHC-codierten „selbst“ Determinanten nicht nur fähig sind zwischen körpereigenen und allogenen Zellen zu unterscheiden, sondern daß dieser Erkennungsmechanismus auch die Grundlage der Erkennung von virusinfizierten eigenen Zellen darstellt
Falsch geprägte T-Lyc werden von Ma ausgemustert. Ein kleiner Teil an falsch geprägten T-Lyc bleibt aber meist erhalten.
Bei pathologischen Prozessen kann dieser Teil zu groß, wodurch es zu Autoimmunerkrankungen kommt. Es gibt natürlich noch viele andere Ursachen für Autoimmunerkrankungen z.B. ein Mißverhältnis zwischen Th und s usw. siehe Lehrbücher der der Pathophysiologie; dort findet man auch nähere Ausführungen z.B. zum Di George Syndrom oder dem Nezelof Syndrom, bei denen ein selektiver Mangel des T-Systems feststellbar ist.
Über das Blut kommen die T-Lyc nach der Prägung in die lymphatischen Organe bzw. Gewebe und v.a. auch in die Lymphknoten (Randzone der Lymphfollikel).
Die T-Effektorzellen (Ti und Tc) sind für die Immunreaktion vom verzögerten Tyxp, cytotoxische Immunreaktion und Transplantatabstoßung verantwortlich.
Dabei sollen die Ti h.s. die Differenzierung der T-Regulatorzellen (Ts und Th) steuern
Für die T-Regulatorzellen gilt, daß die Ts h.s für die Unterdrückung einer Immunreaktion zuständig sind. Die Th hingegen wirken sich fördernd aus, wobei sie auch die B-Lyc stimulieren.
Wird nun ein AG, z.B. ein Tuberkelbakterium, von einem interdigitierenden Ma einem T-Lyc präsentiert, so erkennt dieser nicht nur das AG, sondern auch das Histokompatbilitätsantigen des eigenen Ma und wird aktiviert. Die aktivierten T-Lyc proliferieren und sezernieren Lymphokine.
Lympokine können nun weitere Ma und Mo chemotaktisch anlocken und aktivieren. Die Ma werden dadurch im hohen Maße zur Phagocytose der AG befähigt. Weiters wird durch die Lymphokine die Gefäßpermeabilität erhöht.
Ein Teil der proliferierten Tc werden zu Tc-Gedächtniszellen, wodurch es bei wiederholten Kontakt mit dem gleichen AG zu einer verstärkten und vielleicht auch etwas schnelleren Reaktion kommt. Die Tc-Gedächtniszellen ragieren aber längst nicht so schnell wie die B-Gedächtniszellen, weshalb es, wie gesagt, durch die T-Lyc zu der verzögerten Reaktion kommt.
Die T-Lyc tragen an ihrer Oberfläche also den E-Receptor (menschliche T-Lyc bilden im Unterschied zu B-Lyc mit Schafsery wegen dieses E-Receptors Rosetten aus).
Weiters tragen sie Receptoren für die spezifische AG-Erkennung, Receptoren zur Signalübertragung, Receptoren (OKT bzw. CD 4 und OKT8 ) zur Bindung an MHC-Moleküle der Klasse II bzw. I, sowie LFA-Receptoren u.a. zur Adhäsion an Lc. Diejenigen Ma, welche bei der AG-Präsentation mit T-Lyc in Kontakt treten, tragen MHC Receptoren der Klasse II, und Ma und Lyc müssen, wie bereits erwähnt, kompatibel sein.
Durch den compatiblen MHC-Komplec wird garantiert, daß nur eine Interaktion zwischen Ma und Lyc eines Individuums möglich sind.
Vor der AG-Präsentation wird das AG (welches auch schon kompement-gebunden sein kann) im Ma verändert (processing).
Immunogene Teile des AG werden dann zusammen mit dem major histocompatibility complex molecules, also HLA-DR, -DP und -DQ dem T-Lyc präsentiert.
Die T-Lyc erkennen das AG dann über TCR-Receptoren, welche aus zwei Ketten mit konstanten und variablen Regionen bestehen, welche wie bei den AK unterteilt werden (siehe unten).
Nach der Aktivierung sind v.a. wichtig:
die Sekretion von Il, welches die Proliferation der T-Zellen stimuliert, die Ausbildung von langlebigen Gedächtniszellen, eine ausgewogene Regulation der Immunreaktion durch Th undTs, eine Stimulation der B-Zellen durch Th und natürlich der Effekt der Tc.
Wie erwähnt, bewirken diese die immunologische Überempfindlichkeitsreaktion (allergische Erkrankung) vom Typ IV, also der zellulär bedingten Immunreaktion vom verzögerten Typ. Dazu gehören u.a. die zZerstörung virusinfizierter Zellen, die Transplantat-Abstoßung, die Transplantat-gegen-Wirt-Reaktion und immunulogische Spätreaktionen von Tuberkulintyp.
2.3 Humorale spezifische Abwehr
(humorale Immunität):
Für die humorale Immunreaktion sind die in Körperflüssigkeiten gelösten AK, welche von B-Lyc, den Plasmazellen, produziert werden, verantwortlich. Für die B-Lyc-Prägung gibt es beim Menschen kein spezielles Organ, wie bei den Vögeln, wo sie in der Bursa Fabricii geprägt werden; sie werden im Knochenmark (bone marrow) geprägt.
Bei der Prägung bilden die B-Lyc verschiedene Ig-Moleküle, die an der Oberfläche erscheinen. Nach der Prägung erfolgtz der erste Kontakt mit AG, wodurch die Zellen ihre Immunkompetenz erlangen.
Dabei werden auch Gedächtniszellen gebildet, und die IgD verschwinden von der Oberfläche. Es bleiben Plasmazellen (AK-produzierende Zellen) und Gedächtniszellen übrig, die jeweils Ig der Klassen IgM, IgG, IgA und IgE an ihrer Oberfläche tragen, und die jeweiligen AK produzieren können.
Für viele AG-Arten sind T-Helferzellen bei der Differenzierung der B-Zellen erforderlich.
Dendritische Ma präsentieren den immunkompetenten B-Lyc ein AG, wodurch diese aktiviert werden und proliferieren. In den Lymphfollikeln findet die Proliferation in den Keimzentren statt. Es entstehen B-Lymphocytenklone, die gegen das präsentierte AG, AK erzeugen.
Die AK finden sich im Plasma, Speichel, Tränenflüssigkeit, Liquor und anderen Körperflüssigkeiten, wie z.B. in den serösen Höhlen, also zwischen Serosa visceralis et parietalis.
2.3.1 Antikörper
Schon um 1850 hat Bence-Jones die L-Ketten von AK beschrieben; Dreyer und Bennet entdeckten konstante und variable Domänen und postulierten 1965 das Zwei-Gen-Modell (C-und V-Gene), welches die Entstehung der Vielzahl der verschiedenen AK (Diversität) erklären sollte.
Doch zuerst ein Schema zur Konfiguration der AK:
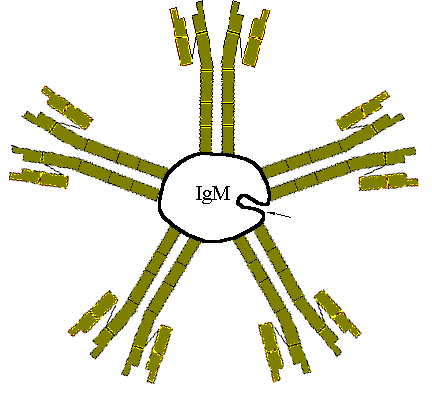
Pentamer mit 10 AG-Bindungsstellen
Abgesehen von der J-Kette gibt es noch weitere Verbindungen zw. H-
bzw. zw. H- und L-Ketten, die hier aber nicht eingezeichnet sind.
J-Kette
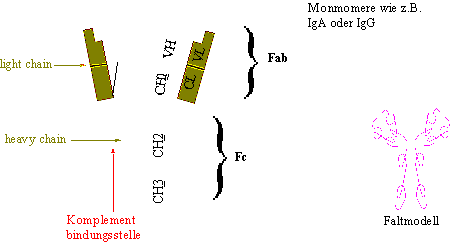
Es gibt etwa fünf verschiedene H-Ketten (heavy chains) und zwei unterschiedliche L-Ketten (light chains), die jeweils in Domänen unterteilt sind. Die Domänen zeigen charakteristische Faltungen (Andeutung in Skizze x) und Stabilisierungen durch Disulfidbrücken auf. Bei den pentameren IgM (und auch bei den dimeren IgA) treten noch sog. J-Ketten (joining) auf, die für den Zusammenhalt der Untereinheiten verantwortlich sind.
Nach der Bindung eines AG an ein AK kommt es zu verschiedenen Reaktionen. Wesentlich ist u.a. auch ob der Fc-Teil Bindungsstellen für Komplementfaktoren aufweist oder nicht.
Kurze Charakterisierung der AK:
IgM sind für die Neutralisation und Agglutination von AG verantwortlich. Außerdem aktivieren sie das Komplementsystem (H-Ketten-Typ:µ).
IgM werden als erstes gebildet, wodurch sie bei einem Erstkontakt stark vermehrt sind, sowie beim Zweitkontakt dann vermehrt IgG zu finden sind. Ein IgM vermag dank seiner 10 Bindungsstellen nicht nur AG zu neutralisieren, sondern bringt, wie gesagt, auch Zellen zur Agglutination (siehe Blutgruppenbestimmung). Die IgM gehören – wie auch die IgG – mit C3b zu den wichtigsten Opsoninen, welche eine Phagocytose fördern bzw. ermöglichen. Weiters vermögen sie dea Komplementsystem zu aktivieren ® Entzündungen ® Chemotaxis, Phagocytose, radikale O2-Metabolite…
IgG sind für die Opsonisierung verantwortlich. Sie können an Tc und an Ma binden, und sie fördern die Phagocytose durch nGc und Ma. Auch sie können das Komplementsystem (klassischer Weg) z.B. bei einer Entzündung aktivieren.
IgG sind die einzigen AK die die Plazentaschranke passieren können und bieten daher schon dem Neugeborenen (IgG von der Mutter) einen Infektionsschutz.
IgG können mikrobielle Toxine neutralisieren. Sie unterstützen auch Killerzellen bei der Abwehr von Viren.
Es gibt verschiedene Subklassen (H-Ketten-Typ: g).
IgG sind im Serum in höchster Konzentration zu finden (verglichen mit den anderen Ig).
IgA funktionieren nautralisierend und können das Kompementsystem über den alternativen Weg aktivieren (H-Ketten-Typ:a)
Sie kommen im Blut als Monomere vor und in Sekreten als Dimere (Speichel, Darm-, Bronchial-, Vaginalsekret, Tränenflüssigkeit…).
Die AK verbinden sich mit einer sekretorischen Komponente und bilden eine erste Abwehrfront auf Schleimhautoberflächen aus. Die AK binden Mikroorganismen und Parasiten u.a. AG.
IgA sind hydrophil (im Gegensatz zu anderen AK), wodurch eine Phagocytose des AG-AK-Komplexes und damit eine Verschleppung des AG ins Innere (Gewebe) verhindert wird.
IgA dienen also v.a. der lokalen Abwehr an möglichen Eintrittspforten für AG. Die Submucosa des Darmes alleine soll fast die Hälfte aller Plasmazellen beherbergen (wofür ich aber keinen Beweis erbringen müssen möchte). Durch AG-AK-Bindung vermag IgA außerdem schädigende Wirkungen von AG (toxische Substanzen) zu neutralisieren.
IgD kommen an der Zellmembran der B-Lyc vor (H-Ketten-Typ:d)
IgE können an Mastzellen und an bGc binden, man findet sie u.a. im Nasen-.und Rachenraum. Pollen können als AG für IgE fungieren – Freisetzung der Mastzellen- und bGc-Granula – allergische Reaktion vom Soforttyp; Heuschnupfen. (H-Ketten:Typ:e).
IgE kommt im Serum nur in sehr geringer Konzentration vor. Sie spielen eine wichtige Rolle bei der Abwehr von Parasiten.
Helminthen-AG können – z.B. über Mastzellen gebundene IgE – die Mastzellen zut Freisetzung chemotaktisch wirksamer Substanzen veranlassen, welche dann eGc anlocken; diese zerstören dann den Parasiten.
Die humorale spezifische Abwehr ist mehr auf Ag, die frei im Blut und im Gewebe (also intracellulär bzw. extracellulär) vorkommen spezialisiert, und die zelluläre Abwehr ist mehr für die Abwehr intracellulärer Mikroorganismen verantwortlich.
2.3.2 Diversität der AK
Um zu erörtern, wie es möglich ist, daß eine spezifische Abwehr von nahezu unbegrenzt vielen verschiedenen Ag stattfinden kann, wie es also zu eine ungeheuerlichen AK-Diversität kommt, müßte man eigentlich, wie so oft, bei Paul Ehrlich beginnen. Ich möchte aber sämtliche Theorien (Schlüssel-Schloß-Prinzip bzw. Seitenkettentheorie bzw. Komplementatitätsprinzip, Instruktionstheorie, Keimbahntheorie, klonale Selektionstheorie und somatische Theorie) überspringen und nur trivial umreißen, wofür N.K. Jerne 1984 und S. Tonegawa den Nobelpreis bekamen.
Die B-Zellen erhalten während ihrer Differenzierung und Prägung nicht nur AK jheweils verschiedender Klassen an ihrer Oberfläche exprimiert, sondern es wird durch somatische Rekombination, also über die DNA der sich differenzierenden B-Zellen ein großes AK-Grundrepertoire an verschiedenen AK angelegt, die noch relativ geringe Spezifität aufweisen.
Tritt nun ein AG auf, so wird es mit demjenigen AK des Basisrepertoire einen Komplex bilden, das am besten zum AG paßt, also die höchste Affinität zum AG aufweist. Diese B-Lyc werden dadurch aktiviert – es kommt zur Proliferation und zur Anlage von Gedächtniszellen (Primärantwort).
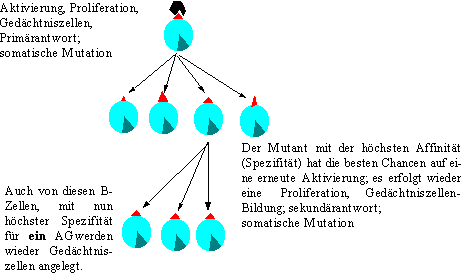
Während der Proliferation (Zellteilungen) können schon somatische Mutationen auftreten. Bei dem nächsten Kontakt mit demselben AG werden wiederum diejenigen B-Lyc aktiviert werden, welche die höchste Spezifität bzw. Affinität aufweisen. durch die Aktivierung kommt es wieder zur Proliferation und Bildung von Gedächtniszellen, während der somatische Mutationen auftreten können (somatisch, weil die B-Zellen nach mehreren Differenzierungen (Generationen) als Körperzellen gesehen werden müssen, und die Änderungen (Replikationen, Mutationen) bzw. die Resultate, nicht über die Keimbahn weitergegeben (vererbt) werden können). Meiner Meinung nach ist die Anlage von Gedächtniszellen, nach dem ersten AG-Kontakt eher ein Hindernis für die Erlangung einer hohen Spezifität, aber es wird dadurch erreicht, daß einerseits die Spezifität höher wird und gleichzeitig die Geschwindigkeit der Immunreaktion erhöht wird.
Schema zur Entstehung der Diversität der AK:

Man fand Genabschnitte, welche für die L-Ketten die Informationen tragen. Diese Segmente werden mit L (leader), V (variable), J (joining) und C (constant) bezeichnet.
Auf der DNA eines embryonalen B-Lyc hat man die Sequenz der Basenpaare analysiert, un mit den klonal gezüchteten Plasmazellen (Myelom) AK verglichen.
Es wurden weiters DNA-Fragmente (Restriktions-fragmente) in Ring-DNA von Bakterien (Plasmide) eingebaut, welche dann die gewünschten DNA-Abschnitte produzierten. Durch Hybridisierungstechniken mit mRNA- und DNA-Restriktionsfragmenten entdeckte man, daß sich auf der DNS L-, V-, J- und C-Segmente befinden, wobei von den V-Segmenten mehrere nahezu homologe Abschnitte nebeneinander liegen.
Während der Differenzierung von B-Lyc werden V- und J-Segmente durch da-zwischenliegende Signalsequenzen zueinander gebracht.
Neben den V-Segmenten liegen Basenpaare in spiegelbildlicher Reihenfolge
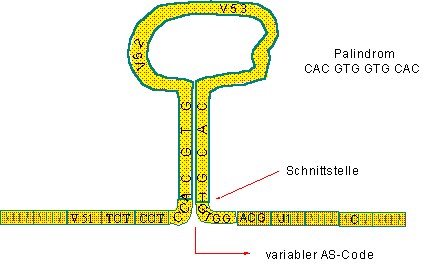
(Palindrome – können von beiden Seiten gelesen werden – wie z.B ANNA oder RELIEFPFEILER) wodurch sich eine Schleife bilden kann, die in einem Stamm zusammengeführt werden kann (siehe Schema unten).
Da diese Palindrom-Sequenzen zwischen V-Segmenten liegen, kann die Schleife ein, zwei oder mehrere V-Sequenzen enthalten und daher unterschiedliche Dimensionen annehmen. Trotzdem kann jedesmal ein gemeinsamer Stamm gebildet werden.
Enzyme spalten dann die Schleife zwischen einem V- und einem J-Segment ab, und damit ist ein bestimmtes J-Segment einem bestimmten V-Segment in der DNA einer B-Zelle nahegebracht worden. Es kann dann abgelesen werde, wodurch aus einer V-, einer J- (aus den mehrere homologen) und einer C-Sequenz eine L-Kette gebildet werden kann (Transkription, Translation).
Bei der Genstruktur für H-Ketten findet man nicht nur J-Segmente, welche die V- und C-Segmente verbinden, sondern hier findet man zusätzlich das D-Segment, welches für die Amiosäuresequenz der CD3-Domänen codiert.
An den Verbindungsstellen zwischen V und D, sowie V und J sind nun ähnliche Variationen wie zwischen V und J bei den L-Ketten möglich, d.h. es können AS-Codes hinzukommen oder auch wegfallen.
Da sowohl für H- als auch für L-Ketten mehrere hunderte V-Segmente vorliegen können (natürlich müssen zwischen V-und J-Segmenten auch Signalcodes liegen), ergibt sich über die Keimbahn (vererbbar) schon eine relativ große Diversität.
Die Kopplungsmechanismen zwischen den einzelnen Segmenten der H-Kette erhöht die Diversität weiter.
Theoretisch ergibt sich, findet man z.B. auf der DNA 450 V-, 8 J- und 12 D-Segmente, ein AK-Repertoire von 1010 verschiedenen AK. J.K. Jerne schätzt das AK-Basisrepertoire auf 106 bis 108.

Die Zahl der verschiedenen vorkommenden AG ist aber sicherlich wesentlich höher. Doch angesichts der Anzahl an AK höchster Spezifität, die sich aus der bereits großen Anzahl an Verschieden AK des Basisrepertoires durch somatische Mutation ergeben können, wird verständlich, wie es zu jedem AG einen AK geben kann.
Schema zur somatischen Rekombination:
Wenn einfach abgelesen wird, entsteht z. B. V53-J1-C.
wird aber J1 dem V52 nahegebracht, so entsteht die mRNA V52-J1-C. Im Schema lasse ich V52 und V53 durch somatische Rekombination enzymatisch herausschneiden, sodaß die mRNA die Segmente V51-J1-C aufweisen wird.
Die „angeborene“, natürliche oder unspezifische Abwehr reagiert zwar schneller als das immunologische Abwehrsystem, dafür ist das immunologische Abwehrsystem eben hoch spezifisch und es kann eine Immunität gegen Krankheitserreger (Gedächtniszellen) bieten.
Außerdem wird beim spezifischen System zwischen Immunreaktionen von Soforttyp und solchen vom verzögerten Typ (Typ IV) unterschieden.
Ich möchte die Systeme aber nicht gegenüberstellen, da es offensichtlich viele Verbindungen undeine gute Zusammenarbei und gegenseitige Ergänzung beider Systeme gibt.
Die Hauptaufgabe der Antikörper ist jedoch in der Erkennung von AG zu sehen, daher auch die hohe Spezifität.
Ich möchte dazu einen Vergleich bringen:
Ein AK hat etwa die Aufgabe eines Sicherheitswachebeamten. Wird ein relativ harmloser Fremdkörper erkannt, der die Sicherheit bzw. Gesundheit gefährdet (AG z.B. eine toxische Substanz), so kann der einzelne Beamte die Angelegenheit selbst bereinigen (Neutralisieren),
IGM und IgG möchte ich aber schon mit Beamten vergleichen. die zumindest mit einer Handfeuerwaffe ausgerüstet sind.
Von jedem Vorfall wird Meldung erstattet, auch wenn der Fall erledigt werden konnte.
Erscheint ein übermächtiger Feind, so wird dieser erkannt und es wird sofort die Alarmabteilung und andere Spezialeinheiten zur Verstärkung herbeigeholt (Komplementsystem – chemotaktische Anlockung von verschiedenen Lc). Außerdem haftet sich der Wachebeamte auf die Spur der Bande (Opsonisierung) und informiert die herbeieilende Alarmabteilung über den jeweiligen Standort.
Das immjunologische Abwehrsystem ist den verschiedenen Sicherheitssystemen aber um einiges überlegen, da es nicht nur ein paar Spezialabteilungen (Kriminal-, Verkehrs-, Staatspolizei…) gibt, sondern 10 x Speziallgruppen (Gedächtniszellen), und dies wäre selbst unter Fürst Metternich unvorstellbar gewesen. Dazu kommt die zelluläre spezifische und die unspezifische Abwehr, welche teilweise selbstständig AG erkennen und abwehren können.
Bei Primäreffekten erscheinen h.s. IgM und bei Sekundärantworten werden mehr IgG gefunden. Dies soll u.a. deswegen sein, weil B-Zellen (Plasmazellen)
zuerst IgM und anschließend IgG und andere AK produzieren soll. Allerdings sind in diesen Punkt die Autoren angeführter Literatur nicht der gleichen Meinung.
Bei zu heftiger Reaktion des Immunsystems komnmt es zu Allergien. Bei Immunmangelkrankheiten reagiert es zu schwach. Werden AK in einem pathologischen Ausmaß oder Verhältnis produziert, so kann das eine Ursache für Autoimmunerkrankungen sein (Näheres finden Sie in Lehrbüchern der Pathophysiologie und Funktionelle Pathologie; hier soll nur noch ein trivbialer Überblich bezüglich Überempfindlichkeitsreaktionen gegeben werden).
2.3.3 Verstärkte Antwort; Überempfindlichkeitsreaktionen
Nach Coombs + Gell kann man in Typen I – V unterscheiden. Bei Betrachtung der durch AK bedingten Reaktionen entfällt Typ IV, da dessen Ursachen h.s. in der zellulären Immunreaktion zu suchen sind.
Die Reaktionen vom Typ I – V können sowohl mit einer Überempfindlichkeits reaktion verbunden sein, als auch ohne einer solchen verlaufen.
Typ I :
Anaphylaktischer Typ; siehe auch Frage „Schock“.
IgE (Reagine) können über Basophile und Mastzellen eine allergische Reaktion vom Soforttyp (Typ I) bewirken (z.B. allergisches Asthma, Heuschnupfen…)
Typ II :
Diese Reaktion wird durch komplementbindende, cytotoxische AK, und durch IgG, welche mit K-Zellen zusammenarbeiten (antibody dependent cellular cytotoxity), hervorgerufen. Wenden sich solche AK der Klasse IgG oder IgM gegen körpereigene Zellen, so kommt es zu Autoimmunerkrankungen. Dabei sind aber immer T-Zellen beteiligt, da Autoantigene ausnahmslos T-Zell-abhängige AG sind (siehe auch symbolische Darstellung auf der rückwärtigen Umschlagseite – die verschiedenen AK bzw. Receptoren sollen dort ein Prä-Prägungsstadium anzeigen).
Auch bei Bluttransfusionskomplikationen kann es durch komplementbindende IgM (Isoagglutinine) zu Reaktionen vom Typ II kommen; siehe auch Rhesus- Incompatibilität – Fragen „Blutgruppenbestimmung und Kreuzprobe“.
Neben Ery können auch Gc, und Thc angegriffen werden, z.B. über Haptene, die an der Membran genannter „Zellen“ anhaften. Dadurch kann es zu …-penien bzw. Anämien kommen.
Typ III :
Diese wird durch Ablagerung von AG-AK-Komplexen an bestimmten Stellen und Aktivierung des Komplementsystems hervorgerufen. Normal werden AG-AK-Komplexe, je nach ihrer Größe, von Phagocyten abgebaut; kleinere können auch übere die Niere ausgeschieden werden. Teilweise können sie aber auch an Basalmembranen liegen bleiben (vermutlich an der Lamina densa der Balallaminae) und Entzündungen hervorrufen.
Typ IV :
Hier handelt es sich um die cellulär bedingte Immunreaktion vom verzögerten Typ. Die Spätreaktion vom Tuberkulintyp soll hier erwähnt sein – Th;
Granulome, Exantheme, Beteiligung an Autoimmunerkrankungen.
Typ V :
Verantwortlich für diese Reaktion sind sog. stimulierende AK, welche Zellen zu erhöhter Aktivität anregen können. Sie treten z.B. bei Morbus Basedow, als Thyroidea-stimulierende AK auf.
Zu den obigen Vergleich soll bzgl. Autoimmunerkrankungen erwähnt werden, daß sich für den Sicherheitswachebeamten, u.U. das Problem ergeben könnte, daß er eine Person vorfindet, welche er zwar eindeutig als fremd erkennt, daß er aber nicht weiß, ob dies nun ein verdeckter Kriminalbeamter auf Verbrecherjagt (z.B. Bankräuber), oder gar ein Bankdirektor bei nächtlicher Kontrolle, oder ein Bankräuber (sei es nun ein Bankdirektor oder ein Kriminalbeamter oder sonst irgend eine raubende Person) ist. Nun, die Sicherheitswache kann hier bestimmt noch eineges verbessen, denn ein Brustschild mit Namen und Dienstgrad ist für Kriminalbeamte wahrscheinlich doch nicht die beste Lösung. Vielleicht könnten sie sich Anleihen am genialen Mechanmismus, den die Natur hervorgebracht hat, um zu einer Immuntoleranz zu gelangen, nehmen.
Auch hier hat P. Ehrlich und K. Landsteiner wertvolle Vorarbeit geleistet, bevor man , etwa 50 Jahre später zur klonalen Selektionstheorie kam.
Für die Tl-Lyc ist gewiß, daß sie im Thymus neben ihren sonstigen T-Zell Receptoren noch CD8- und CD4-Marker ausprägen, welche an MCH-Komponenten der eigenen Thymusepithelzellen binden. Findet der T-Lyc keinegeeignete Bindungsstelle, ist er dem Untergang geweiht. Man spricht hier von positiver Selektion, die über Erkennung körpereigener MHC-Komponenten abläuft. Die T-Zellen bekommen dadurch eine gewisse Autoreaktivität, die aber keine Autoimmunreaktion auslösen,wenn die Zellen höchster Affinität für Autoantigene durch anschließende negative Selektion (durch Ma; Körnerkugel) ausgelesen, d.h. vernichtet und phagocytiert oder zumindest inaktiviert werden.
Auch beiden B-Zellen wird über körpereigene AG eie Selbsttolleranz ausgebildet, wobei aber Th-Zellen mitwirken müssen. Wird der B-Zelle bei der Erlangung der Toleranz aber durch die Th-Zelle „schlecht“ geholfen, z.B. durch Bindung von Haptenen an den Th-Zellen, so kann es zur Bildung von Autoantikörpern im größerem, also pathologischen Umfang kommen, und somit zu einer Autoimmunerkrankung.
2.3.4 Immunsupression
Auch ein Erwachsener kann einerseits durch Applikation sehr hoher AG-Dosen und anderseits durch sehr geringe Dosen an AG eine Immuntoleranz erlangen – ddurch mittlerer Konzentaration hingengen nicht.
Die Lyc werden dadurch zur Immunreaktion unfähig. Mit Cytostatika wird ähnliches erreicht, was dann als Immunsupression bezeichnet wird.
.) Aktive Immunisierung:
Hier werden AG zugeführt, welche eie AK-Produktion bewirken. Bei der antiinfektiösen Impfung werden abgeschwächte Erreger, z.B. Pocken-, Tollwutimpfung, appliziert, oder überhaupt abgetötete Erreger, z.B. Impfungen gegen Thyphus, Ruhr, Cholera…
Von antitoxischer aktiver Impfung spricht man bei Applikation von abgeschwächten Toxinen. Die aktive Impfung bietet erst nch eineígen Tagen eine Schutzm gegen das AG (B-Zellen-Proliferation), wirkt dann aber meist sehr lange (Gedächtniszellen).
.) Passive Immunisierung:
Hier werden v.a. g-Globuline (AK) direkt appliziert, wodurch ein sofort wirksamer Schutz gegeben ist.
Auch beider passiven Impfung wird zwischen antitoxischer und antiinfektiösen Impfsera unterschieden.
Passive Impfung gibt es z.B. gegen Masern, Tetanus, diphterie u.a. Bei aus Tierserum hergestellten AK ist die Gefahr einer AK-Bildung gegen das Tierserum gegeben, wodurch es zur sog. Serumkrankheit oder aber auch zum anaphylaktischen Schock kommen kann.
Bezüglich AIDS möchte ich anmerken, daß die Retrovieren (human immundeficience virus) welche das Acquired Immundeficiency Syndrom verursachen in erster Linie Zellen anfallen, die einen CD4-Marker aufweisen, also h.s. Th-Zellen.
.) Immuntoleranz:
3. Zwischenfragen
- Was wissen Sie über das spezifische Abwehrsystem?
- Welche Zellen gehören zur spezifischen Abwehr?
- Welche Funktion erfüllen die Lymphocyten?
- Wie werden AK gebildet?
- Was wissensie über die Bildung und Wirkung von Lymmphokinen?
- Wie verläuft eine Phagocytose
