
zurück zu Kapitel IV
- 1. Grobe Orientierung
- 2. Morphologische Besonderheiten
- 3. Folgen der morphologischen Besonderheiten für die Mechanik; Herzarbeit; Energiewechsel
- 3.1 Skizze: La Place
- 3.2 Skizze zu den isotonischen und isometrischen Maxima
- 3.3 Diagramm zur Unterstützungskurve
- 3.4 Ausgegangen wird vom Enddiastolischen Volumen (EDV)
- 3.5 Arbeitsdiagramm x für den linken Ventrikel
- 3.6 Die Austreibungsphase
- 4. Das Erregungsbildungs- und Erregungsleitungssystem
- 4.1 Diagramm Schrittmacherpotential
- 5. Elektromechanische Koppelung
- 6. Energieversorgung bzw. Energieverbrauch
- 6.1 Nährstoffverbrauch des Herzens
- 7. Zwischenfragen
1. Grobe Orientierung
Das Herz hat die Aufgabe einer Pumpe. Die im Sinusknoten gebildete Erregung breitet sich über das Vorhofsmyokard aus, wobei dieses erregt wird (das Herzskelet isoliert gegen die Ventrikel). Über das Erregungsleitungssystem wird dann das Ventrikelmyokard erregt und es kommt über die elektromechanische Koppelung zur Zuckung. Durch die Kontraktion und Erschlaffung (Sogwirkung) wird das zum Herzen zurückgeflossene Blut in den kleinen bzw. großen Kreislauf gepumpt, wobei die Richtung des Blutstromes durch die Klappen (Ventilfunktion) festgelegt wird.
Ein Herzcyclus besteht aus Vorhof- und Ventrikelsystole (Kontraktion), sowie Vorhof- und Ventrikeldiastole (Erschlaffung).
Physikalischen Größen und entsprechende Dimensionen:
- Geschwindigkeit: Länge/Zeit
- Beschleunigung: Länge/(Zeit)²
- Impuls: Masse*Länge/Zeit
- Kraft: Masse*Länge/(Zeit)²
Einheit für Kraft = kg m s-² = Newton (Newton ist übrigens ein Eigenname und steht für den Herrn, der in seinen Axiomen etwas über Kraft aussagte [Trägheits-, Aktions-, Reaktionsprinzip]).
Ganz trivial kann man weiters behaupten, Arbeit ist Kraft mal Weg.
So kommt man zur Einheit für Arbeit bzw. Energie – Joule,
wobei 1 Joule 1kg m * m s-² ist; also kg*m²*s-².
Für die Leistung behaupten Physiker, das sie Arbeit pro Zeit ist. Daraus folgt auch schon ihre Einheit, nämlich kg m² s-3, also Watt.
2. Morphologische Besonderheiten
Der Herzmuskel (Hm) ist ein quergestreifter, etwa kegelförmiger Muskel, der ein Holorgane bildet. Die spiralenförmige Anordnung der Muskelfasern ist zu beachten. Auffällig ist weiters – durch die Glanzstreifen – daß er kein anatomisches, sondern ein funktionelles Synzitium darstellt (gap junctions).
D.h., der Hm besteht aus einzelnen, verzweigten, oft einkernigen Muskelzellen (telw. auch Plasmodien), welche perinucleär eine myofibrillenfreie Kernspindel aufweisen.
Das L-System (sarkoplastisches Reticulum) ist im Gegensatz zum T-System (Zellmembraneinstülpung) nicht so deutlich ausgeprägt. Große Flächen der Zellwand (Fascia adhaerentes; intercalared disks, gap junctions).
Im Endomyseum findet man zahlreiche Capillaren, da der Hm das am stärkstem capillarisierte Gewebe ist. Außerdem ist die große Anzahl an Mitochondrien der Hm-Zellen (Färbung bzw. Elektronenmikroskopie) auffällig.
Für den quergestreiften Hm gilt das allgemein über die Gleitfilamenttheorie (Huxley) gesagte. Auch aus der Muskelmechanik sind die Prinzipien übertragbar (Kontraktionsformen, Kraft-Längen-Beziehung: hier Druck-Volumen-Beziehung; Unterstützungsreaktion…). Eine nähere Betrachtung führt uns aber zum nächsten Punkt.
3. Folgen der morphologischen Besonderheiten für die Mechanik; Herzarbeit; Energiewechsel
Der Kraft-Längen-Beziehung entspricht beim Hm die Druck-Volumen-Beziehung.
Grob vereinfacht kann man sich eine Kugel vorstellen, wodurch man die Verhältnisse von Druck bzw. Spannung, Volumen und Wanddicke wesentlich leichter erschließen kann. Die Form bedingt, daß sich das der Länge analoge Volumen zur 3 Potenz der Faserlänge ändert. Außerdem ist bei konstanter Wandspannung (siehe unten) der Innendruck dem Radius umgekehrt proportional.
Wird r kleiner, so wird P größer.
Die Wand des linken Ventrikels ist wesentlich dicker, als die des rechten Ventrikels. In dieser dicken Wand ist die circulär verlaufende (mittlere Schicht) Ringmuskulatur stark ausgebildet.
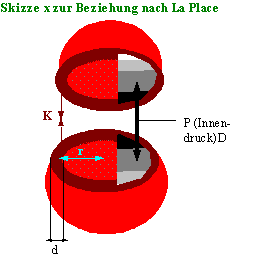
3.1 Skizze: La Place
Beim rechten Ventrikel hingegen sind die äußere und die innere Spiralmuskelschicht stärker als die mittlere Ringmuskelschicht ausgeprägt.
Wenn der „innere“ Radius des Hohlmuskels während der Austreibungsphase abnimmt und die Wanddicke gleichzeitig zunimmt, so kann der Innendruck nopch weiter ansteigen, obwohl die Wandspannung gleich bleibt oder sogar bereits abnimmt.
Die Wandspannung (K) wirkt dem Innendruck entgwegen; die zusammenhaltende Kraft ist, K 2rpd, wenn r<<d>>;
Stellt man sich an beliebiger Stelle einen Schnitt durch die Kugel vor, so wird die Wirkung des Innendruckes (P) verständlich. P (Kraft * Fläche) versucht die zwei Halbkugeln auseinanderzudrängen; P ist überall gleich groß:
Da Pr² = K2rpd und P = K2rpd folgt für den Innendruck
P = K 2d/r also die La Place Beziehung.
Wird nun d größer und r kleiner – wie es bei der Kontraktion der Fall ist, so kann bei gleichbleibender Kraft pro Flächeneinheit (Wandspannung) der Innendruck zunehmen.
Dem Längen-Spannungs-Diagramm des Skeletmuskels entspricht, wie erwähnt, das Druck-Volumen-Diagramm. Bei der Kammeraktion kommt es zuerst zu einer isovolumetrischen Aktivität (isovolumetrische Kontraktion), wobei der Druck bis zum Öffnen der Klappen steigt. Dann erfolgt, mit einer Volumsverminderung einhergehend, eine isotonische Kontraktion.
Das Ausgangsvolumen bedingt die enddiastolische Wandspannung, bzw. den Grad der Dehnung (Vordehnung ) der Hm-Fasern (Vordehnung ist Wandspannung = Vorbelastung = Preload).
Als Nachbelastung = Afterload bezeichnet man die Wandspannung, die den enddiastolischen Aorten- bzw. Pulmonalisdruck (bzw. Widerstand) zu überwinden vermag.
Bei der Herzaktion handelt es sich um eine Unterstützungsreaktion.
Um die Gleichgewichtskurven und das Arbeitsdiagramm des Herzens bestimmen zukönnen, muß zuerst einmal die Ruhe-Dehnungs-Kurve gefunden werden. Am isolierten Herzen wird dazu bei verschiedener Füllung der Druck gemessen (in der klinischen Praxis werden natürlich standardisierte Vorlagen verwendet).
Wie beim Skeletmuskel sieht man, daß auch beim Herz die passive Dehnbarkeit – hier mit wachsendem Volumen – abnimmt; allerdings ist der Hm nicht so gut dehnbar.
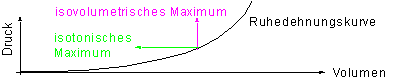
3.2 Skizze zu den isotonischen und isometrischen Maxima
Von jedem Punkt der Ruhedehnungskurve aus, können nun isotonische Kontraktionen und isometrische Aktivitäten ausgelöst werden. Dadurch ergeben sich die Kurven der isotonischen bzw. isometrischen Maxima. Werden die isovolumetrischen Maxima von allen Punkten der Ruhedehnungskurve aus gemessen, so ergibt sich die bereits bekannte Kurve der isovolumertischen Maxima. Aus dieser ist ersichtlich, daß es auch beim Herzmuskel eine Ruhelänge gibt, von der aus die stärkste isovolumetrische Aktivität erreicht wird.
Beim Herzmuskel hat die Definition der Ruhelänge, wie sie für den Skeletmuskel gegeben wurde allerdings nur in einer abgeänderten Form Sinn, denn der Skeletmuskel ist in situ schon auf die „Ruhelänge- Länge aus der die maximale Kraft entwickelt werden kann“ durch die Fixation an das Skelet vorgegeben. Beim Herzmuskel wird diese Bedingung durch das enddiastolische Volumen geschaffen, welches aber im Gegensatz zum Ursprung und Ansatz des Skeltmuskels eine variable Größe darstellt.
Trotzdem ist die Faserlänge, die die Hm-Fasern bei dem Punkt der Ruhedehnungskurve einnehmen, von welchem das größte isovolumetrische Maximum erreicht wird mit der Ruhelänge des Skeletmuskels vergleichbar. Auch hier muß wie beim Skeletmuskel durch die Vordehnung eine Faserlänge erreicht werden, bei der die Myosinfilamente in denem optimalen Grad überlappen (keine gegenseitige Behinderung und trotzdem noch ausreichene Angriffsfläche; siehe Frage 7).
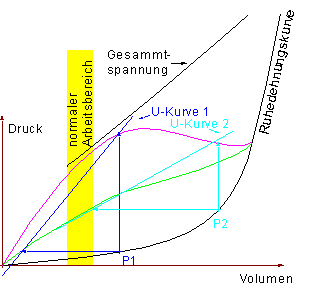
3.3 Diagramm zur Unterstützungskurve
Die Kontraktionsmaxima nehmenb anfänglich bei steigender Füllung (Preload) zu um dann einen Maximalwert zu erreichen (bei der, der Ruhelänge des Skeletmuskels analogen Länge). Wird die enddiastoliche Füllung (Preload) noch weiter erhöht, so nehmen die Kontraktionsmaxima (insbes. das isovolumetrische) wieder ab, bis zu einem Punkt an dem keine Kontraktion mehr möglich ist (die Myosinköpfchen können durch die große Vordehnmung nicht mehr am Aktin angreifen).
Das Diagramm soll verdeutlichen, daß von verschiedenen Vordehnungen aus (punkte auf der Ruhedehnungskurve) verschiedene isovolume-trische Maxima und isotonische Maxima erreicht werden. Dadurch ergibt sich eine, für die jeweilige Ausgangslage charakteristische, Unterstützungskurve.
Mit Hilfe dieser vier Kurven kann nun das Arbeitsdiagramm des Herzens erstellt werden. Dazu werden die Werte einer Herzaktion in das Druck-Volumen-Diagramm eingetragen.
Die nützlichen Dienste, welche das Arbeitsdiagramm zu leisten vermag werden wir später wiederholt in Anspruch nehmen. Die rot eingezeichnete Druck-Volumen-Schleife wird deswegen als Arbeitsdiagramm bezeichnet, da die Fläche innerhalb der Schleife tatsächlich die Dimension einer Herzarbeit (Druck*Volumen) hat.
Es ergibt sich dabei der im Diagramm dargestellte Zyklus:
3.4 Ausgegangen wird vom enddiastolischen Volumen (EDV)
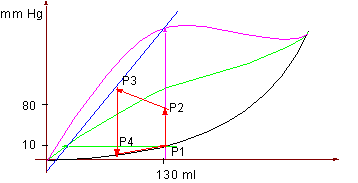
Angenommen das EDV beträgt 130 ml.
3.5 Arbeitsdiagramm x für den linken Ventrikel
130 ml Füllung bedeuten z.B. einen Innendruck von 10 mm Hg und eine gewisse Vordehnung (preload, Vorbelastung), somit ist für diesen Zustand auch ein Punkt auf der Ruhedehnungskurve zu finden. Bezeichnen wir ihn wieder mit P1.
Während der Anspannungsphase (geschlossene Klappen) steigt der Druck durch isovolumetrische Aktivität an, bis der Aortendruck erreicht ist (afterload, Nachspannung, Nachbelastung – die mit den kontraktilen Elementen in Serie geschalteten elastischen Elemente werdenbei der isometrischen Aktivität gedehnt; als Maß für die Nachbelastung gilt die Wandspannung, die aufgebracht werden muß, damit der enddiastolische Aortendruck überwunden werden kann); in unserem Beispiel bei 80 mm Hg.
Bei P2 wird also der Aortendruck erreicht wodurch sich die Klappen (Ventile) öffnen und das Blut ausgeworfen werden kann. Es folgt daher
3.6 Die Austreibungsphase
Bei der Austreibungsphase kontrahiert sich der Hm. Unter gleichzeitiger Volumenverringerung wird dadurch der Druck noch etwas erhöht und erreicht den Punkt P3. Um in unserem Diagramm den P3 (systolischer Druck) zu finden braucht man nur das während der Austreibungsphase ausgeworfene Schlagvolumen vom EDV abziehen (im Beispiel 70 ml), wodurch man zum endsystolischen Volumen (ESV), welches als Restvolumen im Ventrikel verbleibt gelangt. Legt man nun eine zur x-Achse normale Gerade beim ESV, so findet man beim Schnittpunkt mit der U-Kurve den Punkt P3.
Außerdem findet man beim Schnittpunkt mit der Ruhedehnungskurve den P4.
Diesr P4 wird erreicht durch die isovolumetrische Entspannung [3.) Entspannungsphase]. Dabei ist zu beachten, daß sich die Aortenklappen schließen, sobald der Druck etwas abgefallen ist. Der Druck fällt dann weiter rasch ab, bis der Ventrikeldruck unter dem des Vorhofes fällt. Dann bei P4 öffnet sich die AV-Klappe und es kommt zu 4.) der Füllphase.
Die Fläche des Viereckes P1P2P3P4 entspricht der systolischen Druck/Volu men-Arbeit. Die Fläche unter der Ruhedehnungskurve hingegen entspricht der diastolischen Druck/Volumen-Arbeit.
Für die Arbeit haben wir bereits festgestellt, daß sie als Produkt von Kraft * Weg [N] definiert ist. Für die Hubarbeit eines Skeletmuskels rechnet man daher z.B. Gewicht * Weg (Gewicht nicht Masse !!).Beim Hm hingegen wird ein bestimmtes Volumen unter Druckentwicklung gegen einen Widerstand beschleunigt.
Das heißt wir haben hier zumindest 2 Komponenten zu berücksichtigen, nämlich die Druck-Volumen-Arbeit und die Beschleunigungsarbeit. Von der inneren Arbeit möchte ich hier aus Gründen geringer Relevanz für unsere erste Betrachtung absehen.
Die Gesamtarbeit eines Ventrikels kann daher berechnet werden nach:
A = P*SV + m/2*v² (Nm)
Natürlich müßte man die sich während der Herzaktion verändernden Faktoren berücksichtigen, doch erhält man auch mit einer einfachen Näherung brauchbare Werte; daher vereinfacht man gerne wie folgt:
- P = systolischer Mitteldruck am Ventrikelausgang [Pa bzw. mm Hg bzw. N/m²
- SV = Schlagvolumen [m³]
- m = Masse des SV [kg]
- v = mittlere Auswurfsgeschwindigkeit der Blutsäule [m-²]
- (für Ganongbenutzer: 1N entspricht 0,1 kpm; kpm ¹ kgm)
Da die Beschleunigungsarbeit in Ruhe sehr klein ist (ca 1% der Volumenarbeit, ist hier h.s. die Volumenarbeit bzw. Druck-Volumenarbeit, also P*SV von bedeutung. Als Druck-Volumen-Arbei findet man für den linken Ventrikel etwa 1 Nm und für den rechten Ventrikel 0,150 Nm.
Als Wert für die Beschleunigungsarbeit kann man in etwa 0,01 Nm finden, und zwar sowohl für den linken als auch für den rechten Ventrikel.
Wenn man nun von Darstellungen in [2] absieht, denn dort wird bereits die Arbeit in Watt angegeben kann man nun auch die Leistung des Herzens ermitteln.
Ich wiederhole bewußt: Leistung = Arbeit pro Zeit [Watt bzw Nm/s].
Für die Gesamtleistung des Herzens erhält man so im Ruhezustand ca. 1 W.
Da für das Herz durchschnittlich ein Gewicht von 3 N angenommen werden kann, ergibt sich ein Leistungsgewicht (Gewicht/Leistung) von 3 N/W.
Ein Automotor z.B. weist ungefähr ein Leistungsgewicht von 50 N/W auf. Allerdings kann die Herzleistung bei Anstrengung erheblich gesteigert werden und was die Lebensdauer, Energieverbrauch, Umweltverträglichkeit etc. betrifft, so möchte ich auch keinen Ottomotor in meiner Brust mit der Aufrechterhaltung meines Kreislaufes betrauen.
Zugeben muß man aber, daß das Leistungsgewicht schon einen Hinweis liefert, daß das Herz eventuell durch künstliche Pumpen ersetzt werden könnte (siehe [1]).
Zur Abwechslung einmal zwei Zitate zum Thema: Erstes Zitat aus [1]:
“ Klappenfehler. Wer Gelegenheit hat, das Öffnen und Schließen der Herzklappen an einem gefensterten Tierherzen zu beobachten, ist überrascht, mit welcher Schnelligkeit und Präzision diese Bewegungen erfolgen. Infolgedessen (Anmerkung von mir. die Folgerung [Erkentnissgewinnung] wird nun den Versuch rechtfertigen) bedeutet es auch eine schwere Beeinträchtigung der Herztätigkeit, wenn z.B. durch entzündliche Prozesse Veränderungen der Herzklappen entstehen, die eine ungenügende Öffnung (Stenose) oder einen undichten Verschluß (Insuffizienz) zur Folge haben. Den betroffenen Herzteilen wird dadurch eine stärkere Druckentwicklung oder die Förderung eines größeren Volumens aufgebürdet…“ Wer hätte das gedacht, wenn er nicht Tierherzen gefenstert hätte?
Zweites Zitat aus 2
4. Das Erregungsbildungs- und Erregungsleitungssystem
Die rhythmische Pulsation des Herzens entsteht durch Erregungen, die im Herz selbst gebildet werden. Auch ein isoliertes bzw. dem Körper entnommenes Herz schlägt unter bestimmten Bedingungen (O2-Versorgung…) weiter. Man spricht daher von Autorhythmie. Selbst wenn das Herz in einzelne Stücke zerschnitten wird, schlagen diese noch weiter.
Verantwortlich dafür ist das sogenannte Schrittmacher-Gewebe bzw. Erregungsbildungs-Gewebe.
Das Hm-Gewebe zeigt ebryonal allgemein die Tendenz zu einer relativ hohen Spontanaktivität. Die Hm-Zellen, die das spätere Arbeitsmyokard darstellen, geben aber ihre autorhythmische Aktivität auf und entwickeln ein stabiles Ruhemembranpotential (unter bestimmten Bedingungen kann dieses aber wieder verlorengehen und es kommt zur Bildung ektopischer Zenten).
Einige Hm-Zellen spezialisieren sich aber auf die Erregungsbildung.
Sie sind im nativen Präparat schon makroskopisch erkennbar, als relativ große, blaße Zellen (hoher Glykogengehalt und Wasergehalt sowie fibrillenarmut verleiht ihen ein glasartig durchscheinendes Aussehen).
Die Erregungsausbreitung beginnt natürlich an der Stelle, an der die Erregung mit der höchsten Frequenz gebildet wird. Normalerweise geschieht dies im Sinusknoten. Der im rechten Vorhof, beim Abgang der Vena cava sup. gelegene Sinusknoten sorgt in Ruhe für etwa 70 Impulse pro min.
Dieser „aktuelle, primäre“ Schrittmacher weist also eine höhere AP-Frequenz auf als die potentiellen Schrittmacher: nämlich das sekundäre Erregungsbildungszenztrum im Atrioventricularknoten (AV-Knoten) mit f = 40 bis 60/min, und tertiäre Erregungszentren im Erregungsleitungssystem mit f = 30 bis 40/min.
4.1 Diagramm Schrittmacherpotential
Im Sinusknoten herrscht eine ständig erhöhte Na+-Hintergrundleitfähigkeit. Diese bewirkt, daß die negativen Perioden des unsteten Membranpotentials nur etwa -70 mV erreichen. Dadurch können potentialabhängige Na+-Kanäle, falls welche vorhanden sind, nie aktiv werden. Ohne dieser Na+-Hintergundleitfähig-keit würde das Memranpotential in den negativen Perioden näher an das K+-Gleichgewichtspotential (-97 mV) herankommen.
Diese negativen Perioden werden übrigens als maximales diastolisches Potential (MDP) bezeichnet (hier kann man nur schwer von einem Ruhemembran-potential sprechen, da das MDP ja nicht über längere Zeit bestehen bleibt).
Nach [1] liegt das dem Ruhemembranpotential, abgesehen von der zeitlichen Komponente, entsprechende Potential zwischen MDP und Schwellenpotential, denn es heißt dort, daß während der Repolarisation die g K+ über den Ruhewert hinaus ansteigt, wodurch sich das Membranpotential in Richtung EK verschiebt (negativer wird), und das MDP erreicht. Inwiefern dies etwas Besonderes, für den Mechanismus des Schrittmacherpotential spezifisches sein soll ist mir unbekannt, da wir ja gelernt haben, daß meist eine Erhöhung der gK für die Repolarisation verantwortlich ist und, daß es zu einem negativen Nachpotential kommt wenn die, während der Repolarisation erhöhte gK nicht rasch genug auf den Ruhewert zurückfällt.
Bzgl. der Entstehung des Schrittmacherpotentials ist der kurze Sinn der langen Reden, daß man die hohe Na+-Hintergrundleitfähigkeit verantwortlich macht.Neben dem INa der durch die Na+-Hintergrundleitfähigkeit verursacht wird ist auch ein ICa an der Entstehung des Präpotentials = LDP verantwortlich. Wenn das firing level (Schwellenpotential) erreicht wird kommt es zu einem verstärkten Ca++-Einstrom (kein schneller Na+-Einstrom). Zur Repolarisation kommt es wieder kommt es wieder durch erhöhte gK und inaktivation des Ca++-Einstromes. Da normalerweise die Herzfrequenz von der Schrittmacheraktivität abhängt (bei jedem AP im Sinusknoten kommt es zu einem Herzschlag), wirken sich Änderungen des Schrittmacherpotentials natürlich direkt auf die Herzfrequenz aus. Dabei kann:
- das f.l. verschoben werden (die Schwelle wird später erreicht, wenn sie positiver ist als normalerweise);
- die Anstiegssteilheit des Präpotentials kann verändert werden (bei geringerer Anstiegssteilheit, verläuft das Präpotential flacher, woraus folgt, daß die Schwelle später erreicht wird;
- kann das MDP negativer werden (bei gleichbleibendem f.l. wird dieses dadurch ebenfalls später erreicht);
- kann die Repolarisation langsamer verlaufen.
Die im Sinusknoten entstehende Erregung breitet sich dann mit ca. 1 ms-1 über das Vorhofmyokard aus. Das bindegewebige Herzskelett verhindert ein Übergreifeen auf die Kammermuskulatur. Der zwischen Atrium und Ventrikel liegende Atrioventrikularknoten (AV-Knoten) wird von der Erregung über das Vorhofmyokard erreicht.
Der AV-Knoten hat als potentieller, sekundärer Schrittmacher eine geringere Eigenfrequenz als der Sinusknoten, weshalb normalerweise der Zeitpunkt seiner Erregung vom Sinusknoten und der Weiterleitung im Arbeitsmyokard abhängt.
Der AV-Knoten stellt nun den Ausgangspunkt für die Ventrikelerregung dar. Die Erregung wird nach einer Verzögerung (P-Q-Intervall) über das His’sche Bündel und die Tawara-Schenkel zu den Purkinjefasern weitergeleitet. Die Purkinjefäden enden am Ventrikelmyokard und sind für die Erregungsübertragung auf dieses verantwortlich, wobei sie infolge ihrer relativ langen AP-Dauer als eine Art Frequenzsieb wirken. Dann breitet sich die Erregung von innen nach außen und von der Herzspitze zur -basis aus (siehe EKG).
5. Elektromechanische Koppelung
Auf den ersten Blick könnte man meinen, daß die elektromechanische Koppelung beim Skeletmuskel ähnlich wie beim Hm abläuft. Bei genauerer Betrachtung kann man jedoch wesentliche Abweichungen erkennen. Beim Hm wird zwar ähnlich wie beim Skeletmuskel Ca++ aus dem L-System (Zisternen) freigesetzt, doch strömt – durch das AP veranlaßt – auch Ca++ aus dem Extracellulärraum ein. Dieser Ca++-Einstrom kann durch den Sympathicus gesteigert werden, wodurch es zu einem positiv inotropen Effekt (Herzkraftsteigerung; siehe später) kommt.
Ein Unterschied ergibt sich auch schon aus morphologischen Gründen: der Skelettmuskel ist ein anatomisches Synzitium (verschmolzene Zellen zur vielkernigen Faser, welche von einer einheitlichen Membran umgeben ist, die über die motorische Endplatte erregt werden kann), wohingegen der Hm höchstens teilweise Plasmodien*1 und/oder polyploide Kerne aufweist. Die durch die Disci intercalares zusammenhaftenden Zellen werden aber durch die zahlreichen gap junctions zu einem funktionellen Synzitium.
Dies bedeutet natürlich auch das die Kontraktionskraft verschiedenartig gesteuert werden muß, da ja eine Rekrutierung beim Hm nicht möglich ist. Außerdem kann die Kontraktionskraft auch nicht in dem Ausmaß wie beim Skeletmuskel über die Frequenz gesteuert werden, da beim Hm, als weiterer bedeutsamer Unterschied, besondere zeitliche Verhältnisse bei der Abfolge von AP und Kontraktion vorzufinden sind.
Beim Skeletmuskel dauert das AP ja nur einige ms und es kommt, wollen wir den einfachsten Fall betrachten erst zur Kontraktion, wenn das AP bereits wieder abgeklungen ist.
Beim Hm hingegen überschneidet sich die Kontraktion mit der Erregung soweit, daß der Hm bereits wieder erschlafft, wenn die Erregung abgeklungen ist. Durch die sog. Plateauphase (Ca++-Einstrom) wird also erreicht, daß der Hm nicht tetanisierbar ist. Im Hinblick auf seine Funktion als Pumpe ist dies leicht verständlich und sinnvoll.
Daß, als weiterer Unterschied, das L-System nicht so gut ausgeprägt ist wie beim Skeletmuskel, das T-System aber schon, mag daran liegen, daß die Kontraktionskraft-Steuerung beim Hm vom Ca++-Einstrom abhängt.
Das aus der ECF einströmende Ca++ bewirkt die Ca++-Freisetzung aus den Zisternen des L-Systems (Triggereffekt) und wird auch zur Auffüllung des L-Systems während der Erschlaffung verwendet.
Eine Ca++-Pumpe sorgt für den Rücktransport in die ECF und in die Speicher, damit ist sie für die Erhaltung einer bestimmten intracellulären Calcium-Konzentration (< 10-7 mol/l ) verantwortlich.
Es sei hier auch erwähnt, daß während der Erregung womöglich Ca++ freige geben wird, welches am Sarkolem gebunden ist.
6. Energieversorgung bzw. Energieverbrauch
Es kommt nicht von ungefähr, daß Arbeit und Energie in Joule angegeben werden können. Arbeit bedingt einen Energiewechsel. Aber schon zur Aufrechterhaltung von Leben bzw. lebenden Organen ist ein Energiewechsel erforderlich (Basalverbrauch an O2 und energiereichen verwertbaren Verbindungen). Damit das Herz seine lebenswichtige Arbeit verrichten kann muß es chemisch gebundene Energie in kinetische und Wärmeenergie umwandeln können.
Dazu möchte ich einen Ausdruck voranstellen, der zwar etwas komisch klingt, aber sehr einprägsam ist und das wesentlichste auf den Punkt trifft.
Das Herz ist ein „oxidativer Allesfresser“. Die Bezeichnung Allesfresser stammt übrigens nicht von mir, sondern ich habe sie in [1] gefunden. Die Kapitel „Herz und Kreislauf“ in [1] kann ich übrigens nur bestens empfehlen. In bewundernswerter Klarheit und Deutlichkeit wird das Wichtigste didaktisch klug nahegebracht (Passagen mit Tierversuchsergebnissen ausgenommen; die scheinen kommentarlos aus dem Mittelalter oder der Nazi-Zeit übernommen worden zu sein).
Oxidativer Allesfresser weist auf eine der größten „Schwächen“ und auf ein große „Stärke“ des Herzens hin: das Herz ist extrem stark vom O2-Angebot abhängig, kann aber andererseits verschiedenste Nährstoffe verwerten.
Suerstoff und Nährstoffe müssen zunächst einmal über den Coronarkreislauf ans Myokard herangebracht werden, um dort verteilt werden zu können.
Über die Aufname und/oder Auswaschung von Fremdgasen mit bekannter Löslichkeit im Gewebe (NO2, Xenon…) kann die Durchblutung des Myokards festgestellt werden.
Man findet i.e. eine Ruhedurchblutung von 1 ml*g-1*min-1, bei einem Herz mit 300 g Masse also ca 30 ml/min, was ca. 5% des Minutenvolumens (HMV) ausmacht (siehe Frage x).
Die Ruhemyokarddurchblutung beträgt ca. 1 ml*g-1*min-1, 5% des HMV. Sowohl die Durchblutung als auch der O2-Verbrauch kann bei Erfordernis auf das Vierfache gesteigert werden.
Wegen der Steigerungsfähigkeit auf das Vierfache, spricht man auch von einer Coronarreserve, die normalerweise vier- bis fünfmal höher ist als der Ruhebedarf.
Der Coronarkreislauf ist nicht nur von der Pulsation des Aortendruckes (glättende Windkesselfunktion kann hier noch nicht zum tragen kommen) im besonderen Maße beeinflußt, sondern auch die Kontraktion des Hm selbst wirkt sich stark auf die Myokardperfusion aus.
Während der Systole wird der Blutstrom in den Coronararterien unterdrückt (links wegen der höheren Wandspannung natürlich mehr als rechts) und der Ausstrom über den Sinus coronarius gefördert (Auspressung).
Das arterielle Blut enthält etwa 20 ml/dl O2. Da schon im Ruhezustand ca. 70% des O2 ausgenützt werden, kann die Ausnützung bei Mehrbelastung kaum mehr gesteigert werden. Daher muß ein erhöhter O2-Bedarf durch Steigerung der Durchblutung gedeckt werden.
Die Durchblutung hängt dabei von der Druckdifferenz „Aorta – rechter Vorhof“ und von der Weite der Coronargefäße ab. Diese wiederum ist u.a. vom transmuralen Druck und vom Tonus der Gefäße abhängig.
Gesteuert wird die Coronardurchblutung h.s. durch lokal metabolische Faktoren.O2-Mangel ist dabei der stärkste Reiz für eine Dilatation der Coraonargefäße.
Coronargefäßerweiternd wirken aber auch Adenosin und eine erhöhte [K+]e und subendotheliale Faktoren. Es wird auch eine gefäßverengende Wirkung des Sympathicus und ausnahmsweise auch eine gefäßerweiternde Wirkung des Parasympathicus diskutiert.
Als „Güte der Coronardurchblutung“ wird der Quotient aus O2-Angebot und O2-Verbrauch bezeichnet.
Wie gesagt, ist der Mitochondrienreichtum der Hm-Zellen aufällig. Daher ist es nicht verwunderlich, daß der Energiebedarf für die mechanische Arbeit vorwiegend durch oxidativen Abbau der Nährstoffe in den Hm-Zellen abgedeckt wird. Der Herzmuskel kann im Gegensatz zum Skeletmuskel keine Sauerstoffschuld eingehen. Überaus sinnvoll scheint es auch, daß das Herz bei körperlicher Arbeit verstärkt Lactat nutzt, da dieses ja als Metabolit beim anaeroben Abbau von Glucose im Skeletmuskel anfällt. Das Herz sorgt durch die Nutzung des Lactats auch für die Konstanthaltung des pH-Wertes.Ein sehr wichtiger Aspekt für den O2-Verbrauch ist dessen Abhängigkeit von der Herzleistung bei verschiedenem Widerstand und venösem Rückfluß. Aber nicht nur der O2-Verbrauch, sondern auch der Wirkungsgrad ist stark von Zufluß und Widerstand abhängig.
Bei gleicher Herzleistung aber hohem Widerstand steigt der O2-Verbrauch weitaus stärker an, als bei geringerem Widerstand und dafür stärkerem Zufluß. Der Wirkungsgrad ist dagegen bei hohem Widerstand (Druckbelastung) wesentlich geringer, als bei hohem Zufluß (Volumenbelastung) und gleicher Herzleistung.
Im Falle einer Coronarinsuffizienz wird man daher versuchen den Widerstand des Körperkreislaufes zu verringern (Nitroglycerin bei Angina-pectoris-Anfall), um den O2-Verbrauch zu vermindern.
Tension-Time-Index (TTI): Das Produkt aus Systolendauer und mittlerer Myokardfaserspannung gibt Auskunft über den O2-Verbrauch. Der O2-Verbrauch ist nämlich h.s. von der entwickelten Faserspannung und deren Dauer abhängig. Nach La Place (siehe oben) kann man näherungsweise den mittleren systolischen Druck statt der Faserspannung rechnen – allerdings muß dabei gleichbleibende Ventrikelgröße vorrausgesetzt werden. Da durch Änderung der Herzfrequenz die Nettoarbeitszeit verändert wird, wirkt sich eine solche Änderung auch auf den O2-Verbrauch aus, und zwar steigt der O2-Verbrauch i.e. proportional zur Quadratwurzel der Frequenz (Bzgl. O2-Versorgung des Herzens siehe auch unter Anoxie und Wiederbelebungszeit). Es wurde oben bereits angeführt, daß das Herz fähig ist das bei körperlicher Arbeit anfallende Lactat zu verwerten. Eine Besonderheit des Herzens ist, daß sich die prozentuelle Zusammensetzung der verschiedenen Nährstoffe, welche es zu verwerten vermag, in erster Linie nach dem Angebot richtet.
Nährstoffverbrauch des Herzens
Das Herz kann auch einen relativ hohen Anteil an freien Fettsäuren verwerten. Auf jeden Fall wird die beim Abbau der Nährstoffe freiwerdende Energie über Phosphokreatin in ATP umgewandelt, denn nur dieses ist direkt für die Kontraktion nutzbar. Das Phosphokreatin (normal ca. 7-8 µmol/g) kann daher als Indikator für die O2- und Nährstoffversorgung verwendet werden. Der gesamte ATP-Gehalt (ca. 4-6 µmol/g) wird innerhalb von Sekunden mehrmals umgesetzt.
7. Zwischenfragen
- Was wissen Sie über das Schrittmachergewebe?
- Wie sieht das Präpotential aus und wie wird die Schwelle erreicht?
- Wie kommt es zu der „Hierarchie“ im Schrittmachergewebe?
- Von wo geht die Erregung normalerweise aus und warum?
- Warum entladen sich Schrittmacherzellen? (K+-ausstrom?
- Gibt es einen schnellen Na+-Einstrom?
- Wie lange dauert ein AP der Arbeitsmuskulatur? Vergleiche mit der Dauer des AP im Erregungsbildungs- und -leitungssystem!
- Wie wird die Herzaktivität gesteuert?
- Zu Chronotropie, Inotropie, Bathmotropie und Dromotopie siehe unter Regulierung des SV!



Ein Gedanke zu „52.) Der Herzmuskel; Erregungsbildungs- und Erregungsleitungssystem“