zurück zu Kapitel 1

1 Aufbau des Skelettmuskels
Der quergestreifte Skelettmuskel macht rd. 40 bis 50% der Gesamtkörpermasse aus, weshalb er auch in der Physiologie nicht übersehen werden kann.
Er besteht aus Faserbündeln, welche durch die Muskelfasern gebildet werden. Die Muskelfaser (Muskelzelle) ist ein morphologisches Synzitium. D.h., es ist embryonal durch Fusion von einkernigen Myoblasten (paraxiales Mesoderm, Somiten) entstanden. Nach der Verschmelzung spricht man von einer vielkernigen Muskelfaser.
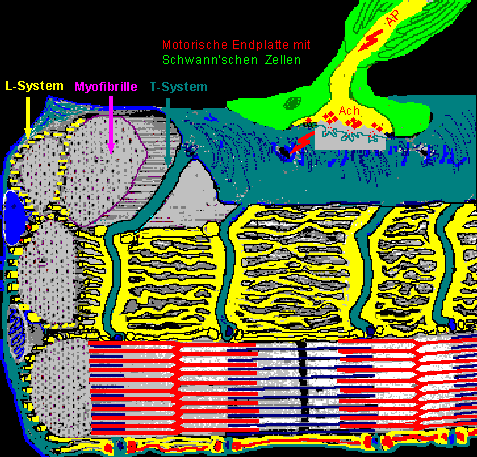
Abbildung 1: Skeletmuskel

Außer den vielen memban- bzw. sarkolemmständigen Kernen fallen zunächst einmal die Myofibrillen auf, die eine Muskelfaser aufbauen. Die Myofibrillen sind wiederum aus Myofilamenten zusammengesetzt, nämlich aus den achsenparallelen dicken Myosinfilamenten (Mf) und den dünnen Aktinfilamenten (Af),sowie dem Tropomyosin und Troponinmolekülen.
Weitere markante Strukturen sind das L-System (longitudinales System – eigentliches sarkoplasmatisches Retikulum, das dem endoplasmatischen Retikulum anderer Zellen entspricht) und das T-System (transversales System – Einstülpungen der Zellmembran bzw. des Sarkolemms). Wie in der Abbildung 1 ersichtlich, liegen diese Tubulus-Systeme zwischen den Myofibrillen.
Auffällig sind auch noch die zahlreichen Mitochondrien (insbes. bei rötlichen Fasern). Die Querstreifung entsteht durch die Anordnung der Myosin- und Aktinfilamente.
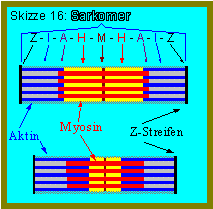
Die Bänder werden bezeichnet mit:
Z – I – A – H – M
Die dünnen Aktinfilamente (Af) sind an den Z-Scheiben befestigt; die Myosinfilamente (Mf) liegen – sowohl im Querschnitt als auch im Längsschnitt gesehen – in der Mitte des Sarkomers.
Die ca. ein µm dicken Myofibrillen sind durch die Z-Scheiben in ca. 2,5 µm lange Sarkomere unterteilt.
Das anisotrope (in polarisiertem Licht doppelbrechend) A-Band entsteht durch Überlappung der Af mit den Mf. In der (H-Zone) liegen nur Mf, oft ist auch noch eine M-Linie in der Mitte zu sehen. Es handelt sich dabei um ein Maschenwerk aus Gerstproteinen, welche die Mf zusammenhalten (siehe Skizze).
nach oben
2 Elektromechanische Koppelung; Gleitfilamenttheorie:
Über die neuromuskuläre Übertragung wird an der Muskelfaser ein Endplattenpotential (AP) ausgelöst (siehe Graphik).
Die Umsetzung des AP von der erregten Zellmembran bis zum Ineinandergleiten der Myofibrillen wird elektromechanische Koppelung genannt.
Zur elektromechanischen Koppelung werden gerechnet:
1.) die Erregungsfortleitung im T-System,
2.) die Ca++-Freisetzung aus dem L-System,
3.) die Ca++-Einwirkung auf die Myofibrillen.
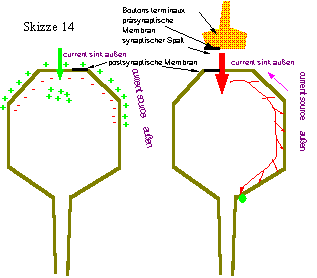
Wenn ein AP an einem Motoaxon die präsynaptische Membran erreicht, wird dort Ach aus den Vesikeln freigesetzt und in den synaptischen Spalt abgegeben. Das Ach bindet dann an Receptoren der postsynaptischen Membran (= Sarkolemm) und löst dort wiederum ein AP aus (überschwelliges Endplattenpotential). Dieses breitet sich mit einer Geschwindigkeit
von 1-5 m/s über die Faser aus und bringt sie innerhalb weniger ms zum Zucken. Dabei wird das AP über die Sarkolemmeinstülpungen (T-System) in die Faser hineingebracht.
Dem T-System benachbart, liegen beiderseits die Zisternen des L-Systemes, in welchem Ca++ gespeichert ist.
Wird diese Struktur (Triade) vom AP erreicht, so wird Ca++ aus dem L-System freigesetzt.
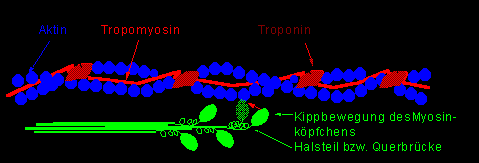
Die Aktinmoleküle sind in zwei umeinandergewundenen, perlschnurartigen Ketten angeordnet, wobei in regelmäßigen Abständen Troponinmoleküle eingelagert sind und in den Längsrinnen Fäden aus Tropomyosin verlaufen.
Das Troponin wirkt sozusagen als Calciumschalter, d.h. die Bindung von Ca++ an Troponin ermöglicht eine effiziente Anlagerung der Myosinköpfchen an die Af, wodurch das Rudern unter ATP-Spaltung ablaufen kann. Dabei wird das Tropomyosin in die Längsrinne des Aktinstranges gedrückt, was der aktivierten Position entspricht.
Die Ca++ in der Zelle müssen in speziellen Speichern gespeichert werden, sonst käme es ja zu unkontrollierten Kontraktionen. Als solche Speicher fungieren, wie bereits erwähnt, die Terminalzisternen des L-Tubulus-Systems
Calciumchelatbildner (z.B. EDTA) lassen den Muskel erschlaffen, da Ca++ für die Aktin-Myosin-Bindung verantwortlich ist (Weichmacher).
Abbildung 2: Muskelfibrille

Durch die Ca++-Wirkung auf Troponin kann sich das Af an das Myosin anlagern, und in Anwesenheit von Mg++ kommt es zur ATP-Spaltung, wodurch die Myosinköpfchen um 45% kippen. Die ATP-ase der Myosinköpfchen benötigt also Mg++ zur ATP-Spaltung.
Das Zusammenwirken der kontraktilen Proteine Aktin und Myosin wird in der Gleitfilamenttheorie beschrieben.
Abbildung 3: Sarkomer

Bei der Verkürzung gleiten die dünnen Af über die Mf bzw. zwischen die Mf. Ineinandergleiten bewirkt Verkürzung, die Sarkomere sind in Serie geschaltet, wodurch sich die einzelnen Verkürzungen (Tauziehprinzip) summieren. Die Querbrücken (Myosinköpfchen) erreichen durch Kippbewegungen (rudern) die Verkürzung.
Bei der Muskelerschlaffung lösen sich die Myosinköpfchen vom Af. Der Muskel kann bei der isometrischen Aktivität auch ohne Ineinandergleiten Kraft entwickeln, wobei den elastischen Teilen der Querbrücken (Hals) eine wesentliche Funktion zukommt.
Obwohl die Querbrücken rhythmisch anfassen und loslassen (innerhalb 1/10 bis 1/100 s), oscilliert (schwingt) die Muskelkraft nicht, da sich das rhythmische Anfassen auf die Sarkomere bezieht.
Auf einen Einzelreiz erfolgt zwar eine maximale Einzelzuckung, aber nicht eine maximale Verkürzung der Faser, da das Ineinandergleiten zu langsam abläuft. Erst wenn während einer Einzelzuckung ein weiterer Reiz auftritt kommt es zu einer stufenweisen Summation (Superposition), wobei es zu einer maximalen Verkürzung der Faser kommen kann.
Zur Kraftentwicklung sind viele Ruderbewegungen in Parallelschaltung nötig.
nach oben
3 Phänomene bei erhöhter Reizfrequenz
Wie bereits angeführt, überlagern sich bei erhöhter Reizfrequenz die Einzelzuckungen. Es kommt zu einer Superposition, bei der die Spannungsmaxima und die Kontraktionsrückstände zunehmen (es erfolgt zwischendurch keine völlige Erschlaffung). Die Zunahme der Gesamtspannung wird nicht auf eine Erhöhung der [Ca++]i zurckgeführt.
Beim Treppen-Phänomen, das laut 2 nichts mit Summation zu tun hat, soll hingegen schon eine erhöhte [Ca++]i ausschlaggebend sein. Die Treppe ist zu beobachten, wenn die Reizfolge gerade unter der tetanisierenden Frequenz liegt. Die Spannung der einzelnen aufeinander folgenden Zuckungen nimmt zu, bis eine Maximalspannung erreicht wird. Siehe auch unter Herzmuskel.
Beim Tetanus, der durch sehr schnelle Reizfolge entsteht (Warmblütermuskel größer 50 Hz), kommt es zu einer Dauerkontraktion, wobei die [Ca++]i ebenfalls erhöht ist.
Zur Auslösung muss das Reizintervall kleiner sein, als 1/3 der Dauer einer Einzelzuckung.
Der minimale Abstand kann aber nicht kleiner sein, als die Refraktärzeit, und diese wiederum ist ungefähr so lang wie das AP.
Die Zuckungsdauer reicht von ca. 7 ms (schnelle) bis ca. 100 ms (langsame Muskelfaser) und das AP dauert etwa 2 bis 4 ms. D.h. bei einer Refraktärzeit von z.B. 2 ms und einer Zuckungsdauer von 50 ms wäre die Faser etwa mit Reizfrequenzen zwischen 17 und 25 Hz tetanisierbar. Versucht man nachzurechnen, so wird klar, dass zunächst einmal die Begriffe “Muskelzuckung” und “Kontraktion” definiert werden müssen.
In 2 wird festgelegt: “Ein einzelnes AP verursacht eine Kontraktion, gefolgt von einer Erschlaffung: dieser mechanische Effekt wird als Muskelzuckung bezeichnet.”
Als Muskelkontraktion wird die Verkürzung! des Muskels durch Ineinandergleiten der Myofilamente festgelegt; als Erschlaffung versteht sich die Verhinderung einer Aktin-Myosin-Wechselwirkung, wodurch die Myosinfilamente in ihre Ausgangsstellung zurückrutschen.
Weiters kann man nachlesen, dass Muskelkontraktionen (nicht Sarkomerkontraktionen) aus summierten Einzelzuckungen bestehen. Das ist aber ein Irrtum, denke ich! Häufig findet man dazu Spannungsdiagramme, welche zeigen, dass die Spannung währen der Zuckung zuerst zunimmt, um gegen Ende der Zuckung wieder auf den ursprünglichen Wert abzusinken. D.h. Die Spannungsänderung nach der Zuckung ist genauso groß wie die Längenänderung nach der Zuckung, nämlich Null.
Die Physiologie Professoren summieren nun die einzelnen Zuckungen zu einer Kontraktion auf.
Interessanter weise scheint in der Physiologie null und null nicht null zu sein. Es ist unglaublich, aber wahr (siehe z.B. 2), in solchen Physiologie Lehrbüchern werden Definitionen gegeben und einige Zeilen später werden diese bereits wieder ignoriert, wobei eine verblüffende Widersprüchlichkeit zutage tritt.
Selbst wenn die Muskelzuckungen zeitverschoben ablaufen, kann ihre Summe niemals eine Kontraktion, sondern höchstens wieder eine Kontraktion + Erschlaffung, also eine Muskelzuckung ergeben, finde ich.
Eine Muskelkontraktion entsteht meiner Meinung nach aus Summation von Muskelfaserkontraktionen und eine Muskelzuckung entsteht aus Summation von Muskelfaserzuckungen. Eine Muskelfaserkontraktion entsteht dann analog dazu aus Kontraktionen der Sarkomere, und eine Muskelfaserzuckung aus Kontraktionen und Erschlaffungen der Sarkomere.
Angenommen ein Muskel besteht aus den Fasern 1 bis 10. Wird der Muskel leicht kontrahiert, so werden z.B. die Fasern 1, 2 und 3 kontrahiert. Dann kann die Faser 1 erschlaffen, dafür wird die Faser 4 kontrahiert. Daraufhin kann die Faser 2 erschlaffen und dafür wird die Faser 6 kontrahiert usw. Es sind zu jedem Zeitpunkt drei Fasern kontrahiert und die Summation dieser Faserkontraktionen ergeben die Muskelkontraktion (es ist wohl klar, dass gemeint ist, dass Spannungen oder Längen summiert werden, denn eine Zuckung und eine Zuckung sind und bleiben zwei Zuckungen).
Wird der Muskel stärker kontrahiert, so werden eben mehrere Fasern rekrutiert und es sind dann z.B. zu jedem Zeitpunkt 6 Muskelfasern konrahiert. Dieser Vorgang stimmt dann auch gut mit der höheren Mathematik überein.
Speziell für den Tetanus bedeutet dies aber, dass nicht Muskelzuckungen überlagert werden können, sondern unvollständige Muskelzuckungen.
Es müßte daher heißen: “Wenn eine zweite (weitere) Muskelzuckung einer erste(re)n überlagert wird (Superposition), so wird aus der erste(re)n Muskelzuckung eine unvollständige Muskelzuckung, da sie ja nicht mehr ungehindert vollständig ablaufen kann.”
Dann, und nur dann, kann aus deren Summation das Phänomen des Tetanus zutage treten.
Wir wissen nun jedenfalls, dass die Muskel-Erschlaffung (nicht zu verwechseln mit der Erschlaffung von Sarkomern) zur Zuckung gehört und können daher leicht nachrechnen, ob die obigen Angaben stimmen können.
D.h. zwischen den AP ist jeweils 60 ms Zeit für eine Muskelzuckung. Als Zuckungsdauer hatten wir 50 ms angenommen. Es ist ersichtlich, dass die Zuckungen ablaufen können, ohne dass eine Veranlassung für eine Superposition oder einen Tetanus gegeben ist. Dies ist verständlich, da ja ein Drittel von 50 ms (Dauer unserer Einzelzuckung) 17 ms sind; als Frequenz wurden im Beispiel auch 17 Hz angenommen.
Bei 30 Hz (30 * 2 = 60; 940/29 ~ 32) bestünde zwischen den AP nur mehr ein Zeitraum von 32 ms, also zuwenig für eine ungehinderte vollständige Muskelzuckung, die 50 ms dauert. In diesem Fall kommt es zur Superposition bzw. zum Tetanus. Beim inkompletten Tetanus treten im Gegensatz zum kompletten Tetanus noch Phasen der teilweisen Erschlaffung auf.
Sowie für das AP, so gilt auch für die einzelne Muskelfaser (Tonusfasern ausgenommen) das “Alles-oder-Nichts-Gesetz”; das bedeutet, dass genau ein AP genau eine vollständige Zuckung einer Muskelfaser auslöst.
Vom Rigor (irreversible Starre mangels ATP) und dem Tetanus (Dauerkontraktion aufgrund hoher AP-Frequenz; Tetanie Krämpfe durch Üererregbarkeit, die ebenfalls eine hohe AP-Frequenz zur Folge hat), ist weiters die Kontraktur zu unterscheiden. Im Gegensatz zum Tetanus müssen bei der Kontraktur keine fortgeleiteten AP auftreten. Die Membran ist aber lokal mehr oder weniger stark dauerdepolarisiert, z.B. bei der Kaliumkontraktur, oder aber auch nicht depolarisiert, z.B. bei der Coffeinkontraktur, welche bei einem normalen EM auftreten kann. Coffein in hoher Konzentration bewirkt ohne Membranerregung eine Kontraktion durch Ca++-Freisetzung aus dem L-System. Bei Kalium wird die Membran depolarisiert, wobei der Grad von der Konzentration abhängt. Eine Absenkung von [Ca++]a würde eine Erniedrigung der [Ca++]i zur Folge haben, wodurch es zu einer Entkoppelung käme, und es könnte trotz Depolarisation keine Kontraktion stattfinden.
Die Myosinköpfchen bleiben am Aktin gebunden, wenn kein ATP zur Verfügung steht (Weichmacherwirkung des ATP).
Die Kontraktion der Tonusfasern (Augenmuskelfasern; Teil der intrafusalen Fasern) ist immer eine Kontraktur, die nicht durch ein AP, sondern durch Depolarisation ausgelöst wird. Die tonischen Fasern folgen also dem Alles-oder-Nichts-Gesetz nicht. Die Kontraktionskraft wird bei diesen Fasern durch die [Ca++]i reguliert (siehe “glatte Muskulatur”).
nach oben
4 Steuerung der Kraftentwicklung
Normalerweise wird die Kontraktionskraft und Geschwindigkeit durch Rekrutierug, d.h. durch Aktivierung von mehr und mehr Fasern gesteigert bzw. reguliert. Von der Rekrutierung abgesehen kann die Kraftentwicklung eines Muskels auch für einzelne Fasern einer motorischen Einheit beeinflußt werden, und zwar durch den Summationseffekt, der bis zum Tetanus steigerbar ist. Durch die asynchronen Zuckungen oder Tetani der verschiedenen motorischen Einheiten kommt es zu einer gleichmäßigen Kontraktion eines Muskels.
Beim glatten (kompletten) Tetanus einer motorischen Einheit ist eine Kontraktionskraft vom doppelten bis vierfachen Ausmaß gegenüber von Einzelzuckungen möglich.
Die Kraft, die ein Muskel entwickeln kann, ist vom physiologischen Querschnitt (Summe der Querschnitte der Einzelfasern) abhängig. Bezogen auf cm2 können quergestreifte Muskeln mehr als 40 N entwickeln. Die Muskelkraft hängt abgesehen von der nervösen Aktivierung (Summation, Tetanus und Rekrutierung), auch von den äußeren mechanischen Bedingungen ab.
Die Kraftentwicklung wird auch von der Ruhedehnung (bzw. der Ausgangslage vor der Kontraktion) beeinflußt, wie wir später noch sehen werden.
Ich möchte nun noch 3 weitere Begriffe anführen, bevor wir zur Muskelmechanik übergehen:
Auch in Ruhe findet man bei den meisten Muskeln eine gewisse Aktivität; dieser durch γ-Fasern beeinflußte “Reflextonus” kann durch geistige Anspannung oder Erregung verstärkt werden; er erlischt nur bei tiefer Entspannung.
Bei einer “Myotonie” ist die Erregbarkeit der Zellmembran stark erhöht.
“Dystrophie” ist eine degenerative Erkrankung, bei der die kontraktilen Elemente betroffen sind.
nach oben
5 Muskelmechanik – Kontraktionsformen
Die auxotonische Kontraktion ist eine Kontraktion, bei der die Muskellänge abnimmt (es ist zu berücksichtigen, dass sich die Sehnen bei Muskelverkürzungen dehnen können), bei gleichzeitiger Zunahme der entwickelten Kraft.
Bei der Isometrischen Kontraktion?? kann sich der Muskel nicht verkürzen, heißt es in gewissen Lehrbüchern, siehe medic-Art Anhang zur Frage 7
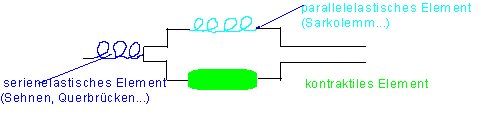
Auch bei der isometrischen Aktivität spannen sich die serienelastischen Elemente der Muskelfaser (Querbrücken, Z-Scheiben, Sehnenansätze…).
Die isotonische Kontraktion ist die Muskelverkürzung bei konstanter Muskelspannung (Belastung).
Die Beziehung zwischen Zugkraft (Last) und Dehnung kann in der Ruhedehnungskurve dargestellt werden.
Der Muskel leistet bei der isotonischen Kontraktion die Arbeit:
Hubhöhe mal Last, wobei die Hubhöhe der Muskelverkürzung entspricht (siehe unten). Diese ist um so geringer, je schwerer die Last ist.
Die charakteristische Beziehung, der im Kontraktionsmaximum erreichten Muskellänge zu der Vorbelastung (pre-load), ist üersichtlich in der Kurve der isotonischen Maxima ersichtlich. Nun ist es zuerst einmal erforderlich zu erklären, was man unter Ruhelänge eines Muskels versteht. Mit Ruhelänge wird die Länge eines Muskels bezeichnet, aus der heraus er die größte Spannung entwickeln kann. Diese Länge entspricht nicht der Länge, die ein isolierter Muskel von selbst einnimmt, sondern der Länge eines Muskels in situ bei entspannter Haltung (dies ist eine sinnvolle Einrichtung der Natur, ob die Bezeichnung auch so sinnvoll ist, mögen Sie selbst beurteilen).
Wenn man einen Muskel von der Ruhelänge aus dehnt, so wird er passiv gespannt, er ist elastisch (aber nicht plastisch wie der glatte Muskel). Die Spannung nimmt dabei nicht linear zu (wie eine Feder im Hooke’schen Bereich), sondern bei größer werdender Belastung nimmt sie zu, wie es in der Ruhedehnungskurve dargestellt wird. Die hierfür verantwortliche Parallelelastizität hat ihr Substrat im Sarkolemm, L-System und in bindegewebigen Strukturen. Die Myofibrillen selbst sind im erschlafften Zustand fast widerstandslos dehnbar, da die Vernetzung der Querbrücken fehlt.
Die Vordehnung bestimmt die Größe der passiven Anspannung des elastischen Muskels, und sie bestimmt auch wieviel Kraft bei der jeweiligen Länge des Muskels zusätzlich entwickelt werden kann, wenn er aktiviert wird.
Der isometrische Kraftzuwachs bei der Kontraktion überlagert sich der passiven Anspannung des Muskels und so wird das isometrische Kontraktionsmaximum bzw. Aktivitätsmaximum erreicht.
Wegen der Parallelschaltung der elastischen, passiven Kräfte zu den aktiven, kontraktilen Kräften ist die Wirkung additiv. Wenn man die Aktivitätsmaxima (Kontraktionsmaxima) bei den verschiedenen Längen des Muskels (oder des Sarkomers) gegen die Muskellänge in ein Diagramm einträgt, erhält man die Kurve der isometrischen Maxima.
Abbildung 4: Sarkomerelemente

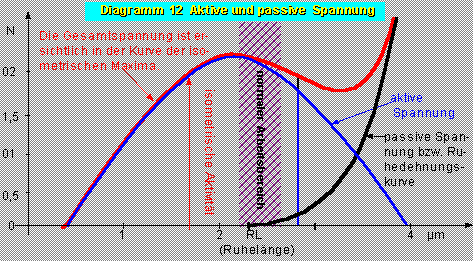
Von dieser Kurve muss die Ruhedehnungskurve subtrahiert werden, um über die aktive Kontraktionskraft eines Muskels (Sarkomers) Aufschluss zu erhalten.
Das Optimum liegt bei den Sarkomeren etwa um zwei µm, was der Ruhelänge (mit Vordehnung!) entspricht.
Bei kleineren Längen behindern sich die Af und Mf gegenseitig, bei größeren Längen können nur weniger Myosinköpfchen wirksam werden, weil eben nur kleinere Teilstücke der Af und Mf überlappen.
Diagramm 1: Spannungs-Diagramm

Bei Längen die größer sind als 3,6 Mikron laufen die Ruhedehnungskurve und die Kurve der isometrischen Maxima zusammen, der Muskel kann dort keine aktive Kraft mehr entwickeln:
Beim Herzmuskel entspricht diesem Längen-Spannungsdiagramm das Druck-Volumen-Diagramm. Der Herzmuskel ist aber nicht so gut dehnbar, d.h. die passive Ruhespannung ist größer als beim Skeletmuskel und der Arbeitsbereich liegt im aufsteigenden Teil der Kurve.
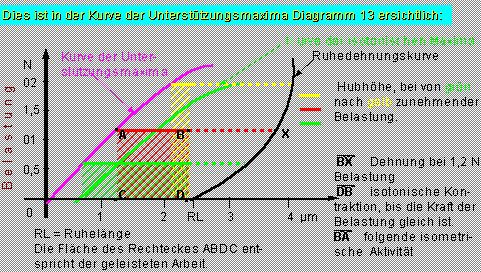
Die Unterstützungskontraktion – ermöglicht den Einfluss der Last auf die Hubhöhe festzustellen und zwar unabhängig von Veränderungen der Vorbelastung. Die Vordehnung wird dabei durch eine Anschlagschraube verhindert (die Last kann den Muskel nicht dehnen).
Diagramm 2: Unterstützungsmaxima

Der tetanisch stimulierte Muskel kontrahiert zuerst isometrisch und wenn dann die Last gleich der Kraft ist, beginnt die isotonische Kontraktion. Die Hubhöhe ist um so größer, je geringer die Belastung ist, daher erreicht der nur wenig belastete Muskel eine geringere Länge (stärkere Kontraktion, größere Hubhöhe). Bei gleicher Belastung ist in der Kurve der Unterstützungsmaxima eine stärkere Verkrzung als bei den isotonischen Maxima zu erkennen.
Zur Ermittlung der Unterstützungsmaxima benötigt man die Ruhedehnungskurve, die Kurve der isotonischen Maxima und die Kurve der isometrischen Maxima. Eine genaue Ausführung finden Sie unter der Frage “Herzcyclus”. Hier wird nur ein Beispiel in Anlehnung an 1 gezeigt.
nach oben
6 Die Muskelarbeit; Verkürzungsgeschwindigkeit
Sie ist das Produkt von Hubhöhe (isotonische Kontraktion) und der Last (entspricht der isometrischen Aktivität).
Arbeit = Kraft mal Weg [N*m = Joule (J)]
Leistung = Arbeit pro Zeit J/s = Watt (W)
Bei mittlerer Belastung ist der Wert der Arbeit am größten. Die geleistete Arbeit ist Null, wenn der Muskel nicht belastet ist, oder, wenn die Last der isometrischen Maximalkraft gleichkommt – der Muskel kann sich dann ja nicht verkürzen – er leistet in diesem Fall aber innere Arbeit, welche in Wärme umgesetzt wird.
Die Kraft eines Muskels, bzw. die Belastung, wirkt sich auch auf die Geschwindigkeit der Kontraktion aus (schneller Schlag eines trainierten Boxers).
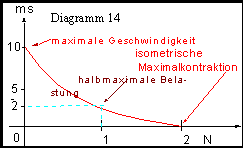
Diagramm Kraft-Geschwindigkeits-Relation

Unbelastet kann sich ein Muskel mit maximaler Geschwindigkeit verkürzen.
Mit zunehmender Belastung (auch die Masse der bewegten Gliedmaßen muss berücksichtigt werden) nimmt die Kontraktionsgeschwindigkeit in hyperbolischer Weise ab, was mit Hill’s Kraft – Geschwindigkeitsrelation zum Ausdruck gebracht werden kann.
Bei halbmaximaler Belastung erreicht die Geschwindigkeit ca. 1/5 des Wertes der Maximalgeschwindigkeit ohne Belastung.
Wenn die Belastung größer ist, als die isometrische Maximalkraft, so wird der Muskel gedehnt. Dadurch kommt es auch zur Bremswirkung durch die Muskeln beim Bergabgehen. Sehr große Lasten (Stemmer) können nur mit geringer Geschwindigkeit gehoben werden. Willkürlich kann man die Geschwindigkeit durch Rekrutierung beeinflussen; je mehr Fasern eingesetzt werden, desto schneller kann die Kontraktion bei geringerer Belastung der einzelnen Fasern erfolgen.
nach oben
7 Muskelwärme, Energieumsatz
Bei der Haltearbeit wird nur “innere Arbeit” geleistet, die in Haltewärme umgesetzt wird.
Als unmittelbare Energiequelle dient ATP.
Kreatinphosphat, Glucose (aerob Abbau zu CO2, H2O und Energie, und anaerober Abbau über Pyruvat zu Lactat bzw. CO2 und H2O) sowie Triglyceride (β-Oxidation) sind nur mittelbare Energiequellen.
Es ist mir übrigens völlig unerklärlich, warum man von “weißen” und von “roten” Muskeln spricht, wo die deutsche Sprache doch über Wörter wie weißich, fahl, bleich oder hell und rötlich, rotbraun, dunkler etc., verfügt. Haben Sie schon einmal einen weißen Muskel gesehen?
Schnelle, weißliche Muskeln können in der gleichen Zeit mehr ATP verbrauchen, als langsame, rötliche Muskeln. Weißliche Muskeln dienen v.a. der raschen Bewegung und sind myoglobinarm.
Rötliche, langsame Muskeln sind reich an Myoglobin und Mitochondrien (oxidative Phosphorylierung; Atmungskette). Sie werden v.a. energiesparend für Haltearbeit eingesetzt. Die meisten Muskeln sind allerdings Mischformen.
Myosin ist eine ATP-ase die bei der Kippbewegung der Myosinköpfchen, durch Actin aktiviert, ATP in ADP und P spaltet. Durch die Anwesenheit von Magnesiumionen++ wird ATP nur gespalten, wenn sich die Myosinköpfchen an den Aktivator Actin anlagern. Der ATP-Verbrauch pro Zeiteinheit ist der Muskelkraft proportional (äußere oder/und innere Arbeit).
Hemmung der ATP-Spaltung bewirkt Erschlaffung der Muskelfasern.
Für die Totenstarre ist kennzeichnend, dass die [ATP] unter einen gewissen Minimalwert absinkt.
Nach dem 1. Hauptsatz der Thermodynamik muss die im Muskel umgesetzte Energie gleich der Summe von mechanischer Energie (Muskelarbeit und Wärmeproduktion) sein. Wenn bei der isometrischen Aktivität auch keine äußere Arbeit geleistet wird, so wird doch chemische Energie in Wärme umgesetzt. Sie ist proportional zur Haltezeit und der dazu erforderlichen Muskelspannung. Die Myosinköpfchen leisten beim Halten eine innere Arbeit. Daher sind Halteleistungen auch ermüdend. Leistet der Muskel Arbeit, so wird er dadurch zusätzlich eine Verkrzungswärme produzieren und dafür ATP verbrauchen. Ein Mol ATP liefert rd. 4 kJ Energie, doch weniger als die Hälfte davon kann in Arbeit umgesetzt werden, der Rest wird in Wärme umgewandelt.
Dadurch kann eine Myofibrille einen Wirkungsgrad von bis zu 50% erlangen, jedoch muss für Erholungsprozesse (Erholungswärme) mit einer Verminderung von 20 – 30% gerechnet werden. Je höher die Arbeitsleistung, um so höher ist der Energiebedarf, womit wir beim Energiestoffwechsel und bei der Sauerstoffschuld angelangt wären.
Bei Dauerleistungen wird das ATP aerob, h.s. durch oxidative Phosphorylierung aufgefüllt. Die Energie stammt v.a. aus der Oxidation von Kohlenhydraten und Fetten. [ATP]i wird auf ca. 5 mmol/l konstant gehalten.
Der arbeitende Muskel kann einen bis zum 1000-fachen Energiebedarf aufweisen. Erhöhter ATP-Verbrauch verlangt eine erhöhte ATP-Synthese, wodurch der 02-Verbrauch ebenfalls steigt. Für die Bildung von einem Mol ATP ist ca- 1/6 Mol 02 nötig. Der oxidative Glucoseabbau ist für die Dauerleistung wahrscheinlich begrenzend. Ein trainierter Langstreckenläufer kann ca. 6 m/s laufen. Die Dauerleistung kann kurzfristig durchbrochen werden (durch anaerobe Glykolyse Glykogenabbau). Für ca. 30 s kann die Leistung auf mehr als das Doppelte der Dauerleistung gesteigert werden. Durch die anaerobe Glykolyse entsteht Lactat und dadurch kommt es zu einer metabolischen Acidose, wodurch die Leistungsfähigkeit eingeschränkt wird (verminderte Enzymaktivität bei verkleinertem pH-Wert).
Es kommt zur Ermüdung. Anaerobe Prozesse treten auch bei Leistungen, die unter der Dauerleistung liegen auf und zwar am Beginn einer Muskeltätigkeit, bis sich der oxidative Stoffwechsel den erhöhten Anforderungen angepaßt hat. Dies ist nach ca. 2 Minuten der Fall (sog. “toter Punkt”). Dann wird soviel ATP durch oxidative Phosphorylierung synthetisiert wie verbraucht wird.
ATP + Kreatin entsteht bis zu diesen Zeitpunkt aus ADP + Kreatinphosphat (Lohmann-Reaktion ). Der Kreatinphosphatspiegel fällt also solange ab, bis die aerobe ATP-Bildung den ATP-Verbrauch ausgleichen kann.
In den ersten Minuten der Erholung wird dann durch Umkehr der Lohmann-Reaktion der Phosphokreatinspeicher unter 02-Verbrauch wieder aufgefüllt. Der dazu benötigte O2 ist sozusagen eine zurückbezahlte Sauerstoffschuld. Sie entspricht der Energie, die der Muskel anaerob umgesetzt hat; durch Hydrolyse von Kreatinphosphat kann sie bis zu 4 l betragen; durch anaerobe Glykolyse bis zu 20 l das dabei gebildete Lactat kann nur durch O2-Verbrauch eliminiert werden. Lactat wird im Herzmuskel oxidiert und großteils in der Leber der Neosynthese von Glykogen zugeführt. Hier sie auch noch angemerkt, dass O2 im Myoglobin gespeichert werden kann.
nach oben
8 Substratumsatz
Ruhende Muskeln verbrauchen h.s. Fettsäuren um den Energiebedarf zu decken. Bei der Umstellung auf Arbeit wird die Glykogenolyse (Leber) und die Glucoseaufnahme gesteigert:
Insulin Glucagon; nach der Arbeit: Insulin fördert die Glucosespeicherung.
Besonders in weißlichen Muskelfasern sind eine hohe Phosphorylase-,Triose-Phosphat-Dehydrogenase- und Lactatdehydrogenase-Aktivität feststellbar.
Die Glycerophosphat-Dehydrogenase ist bedeutsam für den Glycero-Phosphat-Cyclus; (Transport von Reduktionsäquivalenten aus dem Cytosol ins Mitochondrium). NADH + H+ wird oxidiert zu NAD+, wobei über die Glycerophosphat-Dehydrogenase aus Dihydroxyaceton + Phosphat Glycerophosphat entsteht. Dieses wird in das Mitochondrium transportiert. Dort erfolgt die umgekehrte Reaktion, ebenfalls über die Glycerophosphat-Dehydrogenase, wobei nun FAD zu FADH2 reduziert wird.
Im Herzmuskel fehlt die Glycerophosphat-Dehydrogenase. Dort werden die Reduktionsäquivalente über den Malatcyclus in die Mitochondrien transportiert.
Der weißliche Muskel ist gut zur Glykogenolyse und Glykolyse geeignet (geringer Myoglobingehalt).
Bei den rötlichen Muskelfasern hingegen findet man eine Enzymausstattung, die auf bevorzugten Fettsäureabbau und Endoxidation im Citronensäurecyclus hinweist.
Diese Energiegewinnung (-umformung) scheint für Dauerleistungen besser geeignet zu sein. Hier findet man eine hohe Citratsynthase- und 3-Hydroxy-Acyl-CoA-Dehydrogenase-Aktivität.
Grundsätzlich werden Kohlenhydrate oder Lipide zur Oxidation herangezogen. AS-Oxidation zur Abdeckung des Energiebedarfs spielt keine wesentliche Rolle.
Der ruhende Muskel gibt etwa die Hälfte der aufgenommenen Glucose wieder als Lactat ans Blut zurück (anaerober Abbau), ein kleinerer Teil wird als Glykogen gespeichert und der Rest wird oxidiert (zu H2 O und CO2).
Beim Beginn von Muskelaktivität wird die Glucoseaufnahme gesteigert und gleichzeitig die Phosphorylase (Glykogenabbau) aktiviert.
Ein großer Teil der Glucose wird aber nicht oxidiert, sondern als Lactat ans Blut abgegeben. Bei Anstrengungen steigt auch der Catecholaminspiegel, der wiederum die Lipolyse fördert.
Bei Hunger oder Diabetes spielt auch die Oxidation von Ketonkörpern zur Energiebereitstellung eine Rolle.
Außerdem muss den Substratumsatz bereffend natürlich auch der Einfluss von Hormonen berücksichtigt werden, wie dies schon anhand der Catecholaminwirkung ersichtlich ist.
Insulin hingegen steigert zwar die Glucoseaufnahme in die Skelettmuskelzelle enorm, jedoch wird – im Gegensatz zu der Catecholaminwirkung – die Glykogensynthese ebenfalls stimuliert (siehe unter “Insulin”).
Bei Hunger kommt es zu einer erhöhten Proteolyse (Insulin ↓) wobei AS aus der Muskelzelle freigesetzt werden. Diese werden zur Gluconeogenese in der Leber verwendet.
Da der Glucoseabbau sowohl für Dauerleistungen als auch für momentane Höchstleistungen (Sauerstoffschuld) bedeutsam ist, soll dazu noch ein kurzer Überblick gegeben werden.
Bis zum Pyruvat verläuft der anaerobe und aerobe Glucoseabbau gleich (Embden-Meyerhof), siehe auch unter “Gewebeatmung” und Kapitel IV.
nach oben
9 Oxidative Phosphorylierung für Dauerleistungen
Es werden zwei ATP eingesetzt und mit 2 P-Triosen durch Substratkettenphosphorylierung wieder zurückgewonnen. Dabei wird NAD+ reduziert (hydriert) und 3-Phosphoglycerat entsteht. Daraus wird Pyruvat gebildet, wobei ein ATP pro Triose gewonnen wird. Über die Atmungskette kann das NADH. H+drei ATP liefern.
Beim aeroben Abbau wird nun Pyruvat oxidativ decarboxyliert zu Acetyl-CoA, wobei wieder NAD+ reduziert wird. Dieses kann dann wiederum drei ATP liefern. Wenn die aktivierte Essigsäure nun auch noch oxidiert wird, kann aus 1 mol Glucose 38 ATP gewonnen werden.
Das NADH.H+ (welches natürlich auch aus dem Citratcyclus oder der Fettsäureoxidation stammen kann) wird durch die Atmungsketten-Phosphorylierung mit O2 (Myoglobin, Hämoglobin) zu NAD+ oxidiert und die Energie als ATP gespeichert.
nach oben
10 Anaerober Glucose-Abbau
Dieser kommt bei starker, kurzer Belastung zur raschen ATP-Synthese zur Anwendung. Bis zum Pyruvat verläuft der Abbau, wie erwähnt, gleich.
NADH..H+ wird dann aber von der Lactat-Dehydrogenase zu NAD+ oxydiert. Das Pyruvat wird dabei zu Lactat reduziert. Lactat (Milchsäure) wird vom Muskel ins Blut abgegeben und kann in der Leber und im Herzmuskel unter O2-Verbrauch wieder zu Pyruvat oxydiert werden. Dieses findet dann, wie gesagt, in der Leber Verwendung zur Gluconeogenese und im Herzmuskel dient es der ATP-Gewinnung über den Citratcyclus und die Atmungskette.
nach oben
11 Zwischenfragen
- Was ist das Treppen-Phänomen?
- Was ist ein Tonus? (Tonus kommt übrigens vom grch. “tonos” = Spannung)
- Welche Arten von Muskelfasern kann man unterscheiden?
- Welche Muskelfasern zeigen einen hohen Myoglobingehalt?
- Wie unterscheiden sich die versch. Muskeln bezgl. der Tetanisierbarkeit (Herzmuskel)?
- Was versteht man unter motorischer Einheit?
- Was bewirkt die Vordehnung?
- Welche Kontraktionsarten können unterschieden werden?
- Zeichnen Sie die Ruhedehnungskurve auf (natürlich ist diese auch zu erklären)!
- Zeichnen Sie die Kurve der isometrischen Maxima!
- Erklären Sie die elektromechanische Koppelung!
nach oben